Compostos saturados e insaturados
| Compostos insaturados | |
|---|---|
| Eteno ou etileno | Etino ou acetileno |
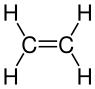
|
|
| Ácido linolénico (ácido graxo) | |
| Compostos saturados | |
| Etano | |

| |
| Ácido palmítico (ácido graxo) | |
En química orgánica un composto insaturado é aquel no que non todos os enlaces carbono-carbono son simples (C-C), senón que hai polo menos un enlace carbono-carbono dobre (C=C) ou triplo (C≡C). Cando todos eses enlaces son simples denomínase composto saturado. Os enlaces simples forman orbitais enlazantes de tipo sigma (σ), mentres que os enlaces dobres ou triplos teñen tanto orbitais sigma (σ) coma pi (π).[1] Os hidrocarburos saturados ao ter só enlaces simples C-C conteñen o maior número de hidróxenos posible,[2] e son os alcanos (como o etano, H3C-CH3), mentres que os insaturados son os alquenos (con enlaces dobres, como o eteno ou etileno, H2C=CH2) e alquinos (con enlaces triplos, como o etino ou acetileno, HC≡CH).
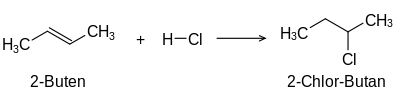
Se a un composto insaturado se lle engaden hidróxenos nos carbonos que formaban enlaces dobres ou triplos convértese nun composto saturado. Aos compostos insaturados poden engadírselles tamén outros átomos, como os halóxenos; por exemplo o cloro na reacción de adición:[3]
- H2C=CH2 + 2 Cl2 → H2(Cl)C-C(Cl)H2

O índice de iodo é unha escala utilizada para definir o grao de insaturación dun composto orgánico con enlaces dobres ou triplos entre carbonos, por exemplo, un ácido graxo. Defínese como os gramos de iodo que reaccionan con 100 g da substancia.
Os compostos insaturados son en xeral menos estables no sentido termodinámico que os compostos saturados correspondentes: a adición de átomos nos enlaces múltiples vese favorecida debido a esta inestabilidade, o que permite utilizalos en numerosas reaccións como produtos iniciais (por exemplo na soldadura con acetileno). Esta inestabilidade obsérvase tamén en numerosas reaccións químicas, xa que certos intermediarios das reaccións/estados de transición son compostos insaturados, como na reacción de Wittig.
Os compostos insaturados son moi variados en estrutura. Poden ser liñais, ramificados, cíclicos. Algúns compostos cíclicos que conteñen enlaces simples e múltiples denomínanse aromáticos e presentan nos seus enlaces electróns pi deslocalizados (por exemplo, o benceno). Poden levar unidos tamén diversos grupos químicos.
Os compostos orgánicos aos que se lles denomina saturados poden conter dobres enlaces establecidos entre os carbonos e outros átomos distintos do carbono. Por exemplo, cando se di que un ácido graxo é saturado referímonos a que a súa cola hidrocarbonada só ten enlaces simples entre os carbonos, pero no grupo funcional ácido do seu extremo (COOH) o carbono forma un dobre enlace co oxíxeno. Precisamente, unha forma de clasificar os ácidos graxos é distinguir entre saturados e insaturados, xa que as súas propiedades son diferentes. Os dobres enlaces dos insaturados fan que a molécula sexa máis ríxida, teña unha curvatura, forme menos enlaces de van der Waals con outras moléculas iguais veciñas e teña menor punto de fusión. Esta diferenza nos puntos de fusión fai que os lípidos con ácidos graxos insaturados tendan a ser líquidos (aceites) a temperatura ambiente, mentres que os saturados tendan a ser sólidos (sebos). Os lípidos con varios ácidos graxos, poden conter á vez ácidos graxos saturados e insaturados. Un ácido graxo pode ter un só enlace múltiple entre os carbono, e nese caso chámase monoinsaturado, ou pode ter varios, e nese caso chámase poliinsaturado.
Nas cadeas hidrocarbonadas o dobre enlace impide a rotación arredor do átomo. Se nun dobre enlace entre carbonos os átomos unidos a eles (por exemplo hidróxenos ou, na figura, cloros) están na mesma posición dise que é un composto cis, e se están en distintas posicións, dise que é un composto trans. Isto crea isómeros cis-trans con distintas propiedades. Por exemplo, os ácidos graxos cis son os máis abondosos na natureza e considéranse máis saudables, xa que son metabolizados no corpo máis doadamente.
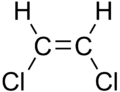 |

|
| cis-1,2-dicloroeteno | trans-1,2-dicloroeteno |
Igual que se fala de compostos insaturados, pode falarse tamén de aneis insaturados, enlaces insaturados (dobres ou triplos) etc.
Notas
[editar | editar a fonte]- ↑ R. E. Dikerson, H. B. Gray, G. P. Haight. Principios de Química. Editorial reverté, s.a. Páxinas 474-479. ISBN 84-291-7139-8.
- ↑ "The Saturated Hydrocarbons, or Alkanes". Purdue University Division of Chemical Education.
- ↑ Saffioti, Waldemar. Fundamentos de Química. Companhia Editora Nacional. São Paulo, Brasil. 1968
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Robert T. Morrison, Robert N. Boyd, and Robert K. Boyd, Organic Chemistry, 6th edition (Benjamin Cummings, 1992, ISBN 0-13-643669-2.
