Sistema inmunitario adaptativo
O sistema inmunitario adaptativo, tamén chamado sistema inmunitario adquirido ou sistema inmunitario específico, está composto por un conxunto de células e procesos moi especializados, que permiten eliminar ou impedir o crecemento de patóxenos, que se desenvolven ao longo da vida do organismo. Son mecanismos propios deste sistema, por exemplo, a produción de anticorpos, a actividade citotóxica das células T CD8+, ou a inmunización por formación de células de memoria.
Estes mecanismos da inmunidade adaptativa contrapóñense aos da chamada inmunidade innata no sentido de que os receptores específicos para os patóxenos da inmunidade innata están codificados xa na liña xerminal, mentres que os receptores específicos de patóxenos da inmunidade adquirida adquírense por medio dun proceso de expresión somática durante a vida do organismo (por exemplo forma un receptor ou un anticorpo específicos contra un antíxeno co que o corpo tivo contacto). Pode dicirse que ambos os sistemas inmunitarios son "adaptativos" no sentido fisiolóxico e evolutivo, xa que ambos os dous permiten que o organismo se adapte ás condicións externas cambiantes. Ambos os dous poden ser tamén desadaptativos no sentido de que a súa sobreactivación pode dar lugar a unha inflamación patolóxica ou a autoinmunidade. Tanto os receptores de patóxenos dos mecanismos da inmunidade innata coma da adquirida son específicos, pero esta especificidade é distinta, xa que a da innata evolucionou durante millóns de anos para facer fronte ás características moleculares moi conservadas do mundo microbiano, mentres que a especificidade da adaptativa madura en cada organismo. Por esta razón, o termo adquirida prefírese en xeral ao de adaptativa ou específica.
Todos os vertebrados adquiriron na súa evolución sistemas inmunitarios. Os vertebrados ágnatos (sen mandíbula, como as lampreas) xeraron receptores do sistema inmunitario adquirido utilizando segmentos variables baseados en repeticións ricas en leucina que se reordenaron no ADN por medio da actividade dun encima citosina desaminase. Polo contrario, os vertebrados mandibulados (gnatóstomos) xeraron receptores do sistema inmunitario adquirido utilizando segmentos variables relacionados coa familia das inmunoglobulinas reordenados no ADN por unha recombinase RAG. O sistema inmunitario adquirido actívase polo máis vello evolutivamente e “non específico” sistema inmunitario innato (que é o principal sistema de defensa contra os patóxenos de case todos os outros seres vivos non vertebrados). As respostas inmunitarias adquiridas proporcionan ao sistema inmunitario dos vertebrados a capacidade de recoñecer e lembrar patóxenos específicos (para xerar inmunidade), e para organizar un ataque máis potente cada vez que se encontre co mesmo patóxeno. É "adaptativo" no sentido de que prepara o sistema inmunitario do corpo para futuros ataques polo mesmo patóxeno. Pero é "desadaptativo" cando dá lugar a un proceso de autoinmune.
O sistema é moi adaptable debido a que se producen hipermutacións somáticas (un proceso de mutación somática acelerada), e recombinación V(D)J (unha recombinación xenética irreversible de segmentos dos xenes dos receptores de antíxenos). Este mecanismo permite que un pequeno número de xenes orixine un enorme número de receptores de antíxenos diferentes, que despois se expresarán unicamente nun determinado linfocito. Como a reordenación de xenes dá lugar a un cambio irreversible no ADN de cada célula, todas células orixinadas por división da primeira herdarán os xenes que codifican a mesma especificidade de receptor, incluíndo as células B de memoria e as células T de memoria que son a chave para que exista unha inmunidade específica a longo prazo.
A teoría da rede inmune, elaborada principalmente por Niels Kaj Jerne, explica como funciona o sistema inmunitario adquirido, e está baseada nas interaccións entre "idiotipos" (características moleculares únicas dun clonotipo) e "anti-idiotipos" (receptores antixénicos que reaccionan co idiotipo como se este fose un antíxeno estraño).
Funcións
[editar | editar a fonte]A inmunidade adquirida entra en acción nos vertebrados cando un patóxeno consegue evadir o sistema inmunitario innato e (1) xera un nivel limiar de antíxenos e (2) xera sinais de ser "estraño" ou "perigoso" que activan ás células dendríticas.[1]
As principais funcións do sistema inmunitario adquirido son:
- Recoñecemento de antíxenos específicos “non propios” en presenza dos “propios”, durante o proceso de presentación de antíxenos.
- Xeración de respostas que están deseñadas para eliminar patóxenos específicos ou células infectadas por patóxenos.
- Desenvolvemento de memoria inmunolóxica, na cal cada patóxeno será “lembrado” por unha sinatura de anticorpos ou receptores de células T. Estas células de memoria poden ser activadas para eliminar rapidamente un patóxeno se ocorrese unha infección posterior por ese mesmo patóxeno.
Linfocitos
[editar | editar a fonte]- Artigo principal: Linfocito.
As células do sistema inmunitario adquirido son linfocitos T e B, un tipo de leucocitos. As células B e T son os tipos principais de linfocitos. O corpo humano ten arredor de 2·1012 linfocitos, que constitúen o 20-40% dos glóbulos brancos; a súa masa total é aproximadamente a mesma ca a do cerebro ou fígado.[2] O sangue periférico contén un 2% de linfocitos circulantes; o resto móvese dentrodos tecidos e sistema linfático.[2]
As células B e T derivan das mesmas células nai hematopoéticas multipotentes, e son morfoloxicamente indistinguibles antes da súa activación.[3] As células B desempeñan un gran papel na resposta inmunitaria humoral, mentres que as células T están intimamente implicadas nas respostas inmunitarias mediadas por células. En todos os vertebrados excepto os ágnatos, as células B e as T derivan de células nai da medula ósea.[3] As células proxenitoras das células T migran desde a medula ósea ao timo, onde se denominan timocitos e onde se desenvolven en células T. Nos humanos, aproximadamente o 1-2% do conxunto de linfocitos recircula cada hora para optimizar as oportunidades de que os linfocitos específicos para antíxenos encontren o seu antíxeno afín nos tecidos linfoides secundarios.[4]
Nun animal adulto, os órganos linfoides periféricos conteñen unha mestura de células B e T en polo menos tres estados de diferenciación:
- Células virxes que maduraron, deixaron a medula ósea ou o timo, entraron no sistema linfático, pero non atoparon aínda o seu antíxeno afín.
- Células efectoras que foron activadas polo seu antíxeno afín, e están activamente implicadas na eliminación dun patóxeno.
- Células de memoria, que son as superviventes de vida longa de linfocitos que interviñeron en pasadas infeccións.
Presentación de antíxenos
[editar | editar a fonte]- Artigo principal: Presentación de antíxenos.
A inmunidade adquirida baséase na capacidade das células inmunitarias de distinguiren entre as células do propio corpo e os invasores non desexados. As células do hóspede expresan antíxenos "propios". Estes antíxenos son diferentes dos que están presentes na superficie das bacterias ou na superficie de células do hóspede infectadas por virus (que serían os antíxenos "estraños" ou "non propios"). A resposta inmunitaria adquirida actívase ao recoñecérense os antíxenos estraños no contexto celular dunha célula dendrítica activada por sinais de perigo.
Coa excepción das células non nucleadas (como os eritrocitos), todas as células poden presentar antíxenos por medio das moléculas do complexo maior de histocompatibilidade (MHC).[3] Algunhas células están especialmente equipadas para presentar os antíxenos, e para cebar ás células T virxes. As células dendríticas e células B (e en menor medida os macrófagos) están equipadas con ligandos coestimulatorios especiais recoñecidos por receptores coestimulatorios das células T, e denomínanse células presentadoras de antíxenos profesionais (APC).
Varios subgrupos de células T poden ser activados por células presentadoras de antíxenos profesionais, e cada tipo de célula T está especialmente equipada para tratar cada posible toxina ou patóxeno bacteriano ou viral. O tipo de células T que son activadas, e o tipo de resposta xerada dependen, en parte, do contexto no cal a célula presentadora encontra por primeira vez o antíxeno.[1]
Antíxenos exóxenos
[editar | editar a fonte]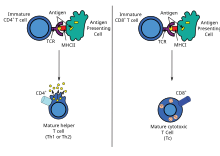
As células dendríticas fagocitan os patóxenos exóxenos, como bacterias, parasitos ou toxinas nos tecidos e despois migran, seguindo sinais quimiotácticos, aos ganglios linfáticos ricos en células T. Durante a migración, as células dendríticas sofren un proceso de maduración na cal perden a maioría da súa capacidade de fagocitar outros patóxenos e desenvolver a capacidade de comunicarse con células T. As células dendríticas usan encimas para romper o patóxeno en pequenos cachos, que son os que serán presentados como antíxenos. No ganglio linfático, a célula dendrítica desprega estes antíxenos "non propios" na súa superficie unidos a un receptor "propio", que é unha molécula do complexo maior de histocompatibilidade, ou MHC.[1] O complexo MHC:antíxeno é recoñecido polas células T que pasan polo ganglio linfático. Concretamente, os antíxenos exóxenos son normalmente presentados unidos a moléculas MHC de clase II, que activan as células T axudantes CD4+.[1]
Antíxenos endóxenos
[editar | editar a fonte]Os antíxenos endóxenos son os producidos por virus que se replican dentro da célula hóspede. Non foron, pois, fagocitados desde fóra da célula, senón producidos no seu interior.[1] A célula hóspede utiliza encimas para dixerir as proteínas virais, e mostra os seus fragmentos unidos ás moléculas MHC na súa superficie ás células T. Os antíxenos endóxenos son tipicamente presentados unidos ás moléculas do MHC de clase I, e activan as células T citotóxicas CD8+. Coa excepción das células non nucleadas (como os eritrocitos), as moléculas MHC de clase I exprésanse en practicamente todas as células do hóspede.[1]
Linfocitos T
[editar | editar a fonte]- Artigo principal: Célula T.
Linfocitos T CD8+ e citotoxicidade
[editar | editar a fonte]- Artigo principal: Linfocito T citotóxico.
As células T citotóxicas (TC ou CTL) son un subgrupo de células T que inducen a morte de células que están infectadas por virus (e outros patóxenos), ou están danadas doutro modo ou son disfuncionais.[1]
As células T citotóxicas virxes actívanse cando os seus receptores TCR interaccionan fortemente cun péptido unido a unha molécula do MHC de clase I da superficie celular. Esta afinidade por ese péptido depende do tipo e orientación do complexo antíxeno/MHC, e é o que mantén unidas a célula T citotóxica e a célula infectada.[1] Unha vez activada o linfocito citotóxico sofre un proceso chamado expansión clonal no cal adquire funcionalidade, e divídese rapidamente, para producir un grupo de células efectoras “armadas”. As células T citotóxicas activadas viaxan despois polo corpo na procura de células que leven ese único complexo MHC de clase I + péptido.
Cando se expoñen a esas células somáticas infectadas ou disfuncionais, os linfocitos citotóxicos efectores liberan perforina e granulisina: citotoxinas que forman poros na membrana plasmática das células diana, o que permitirá que flúan ións e auga ao interior da célula infectada, causando que estoupe ou se lise.[1] Os linfocitos T citotóxicos liberan o encima grancima, unha serina protease que entra nas células por eses poros formados e induce a apoptose (morte celular). Para limitar os danos nos tecidos durante unha infección, a activación das células T citotóxicas está estritamente controlada e xeralmente require un sinal moi forte de activación polo MHC/antíxeno, ou a activación adicional de sinais proporcionados polas células T "axudantes" (ver abaixo).[1]
Unha vez resolta a infección, a maioría das células efectoras morren e son eliminadas polos fagocitos, pero unhas poucas delas mantéñense vivas en forma de células de memoria.[3] Cando se produce un segundo encontro co mesmo antíxeno, estas células de memoria diferéncianse rapidamente en células efectoras, acortando drasticamente o tempo requirido para organizar unha resposta efectiva.
Células T axudantes
[editar | editar a fonte]- Artigo principal: Célula T axudante.

Os linfocitos T axudantes CD4+ son mediadores da resposta inmune, e xogan un importante papel no establecemento e maximización das capacidades das respostas inmunitarias adquiridas.[1] Estas células non teñen actividade citotóxica nin fagocítica; e non poden matar a células infectadas ou eliminar patóxenos, pero, en esencia, son as que "xestionan" a resposta inmune, porque dirixen a outras células a realizar esas tarefas.
As células T axudantes expresan os receptores de células T (TCR), que recoñecen os antíxenos unidos a moléculas MHC de clase II da superficie celular. A activación das células T axudantes virxes causa que liberen citocinas, que inflúen na actividade de moitos tipos celulares, incluíndo a da célula presentadora de antíxenos que a activou. As células T axudantes requiren un estímulo para a activación moito máis suave ca o requirido polas células T citotóxicas. As células T axudantes poden proporcionar sinais extra que "axudan" a activar ás células citotóxicas.[3]
Th1 e Th2: respostas das células T axudantes
[editar | editar a fonte]Existen dous tipos de respostas das células T axudantes CD4+ efectoras que poden ser inducidas polas células presentadoras de antíxenos, denominadas Th1 e Th2, que se utilizan para eliminar distintos tipos de patóxenos. Os factores que determinan se unha infección desencadeará unha resposta de tipo Th1 ou Th2 non se comprenden totalmente, pero a resposta xerada xoga un importante papel na eliminación de diferentes patóxenos.[1]
A resposta Th1 está caracterizada pola produción de interferón-gamma, o cal activa as actividades bactericidas dos macrófagos, e induce ás células B a produciren anticorpos opsonizantes (que cobren as células) e que fixan o complemento, e ten lugar unha "inmunidade mediada por células".[1] A resposta Th2 caracterízase pola liberación de Interleucina 4 (IL-4), o cal ten como resultado a activación das células B para que produzan anticorpos non citolíticos neutralizantes, que realizan unha "inmunidade humoral".[1] Xeralmente, as respostas Th1 son máis efectivas contra os patóxenos intracelulares (virus e bacterias que están no interior das células do hóspede), mentres que as respostas Th2 son máis efectivas contra bacterias extracelulares, parasitos como helmintos (vermes) e toxinas.[1] Igual ca as células T citotóxicas, a maioría das células T axudantes CD4+ morren unha vez que se resolveu a infección, quedando só unhas poucas células de memoria CD4+.
O VIH pode trastornar o funcionamento do sistema inmunitario ao atacar ás células T CD4+, precisamente as células que poderían levar á destrución do virus, mais tamén as células que dirixen a inmunidade contra todos os outros patóxenos cos que o organismo se pon en contacto ao longo da vida, polo que aparecen moitas infeccións oportunistas.[3]
Un terceiro tipo de linfocito T, as chamadas células T reguladoras (Treg), limita e suprime o sistema inmunitario, e pode controlar respostas inmunitarias anormais contra antíxenos propios (autoinmunidade), o que é un importante mecanismo no control do desenvolvemento de enfermidades autoinmunes.[3]
Células T γδ
[editar | editar a fonte]- Artigo principal: Célula T gamma/delta.
As células T γδ posúen un receptor de células T alternativo ao das células T CD4+ e CD8+ αβ, e comparte algunhas características coas células T axudantes, as T citotóxicas e as asasinas naturais. Igual que outros tipos non convencionais de células T que levan receptores de células T (TCRs) invariables, como son o CD1d restrinxido ás células T asasinas naturais, as células T γδ mostran características que as sitúan no límite entre a inmunidade innata e a adaptativa. Por unha parte, as células T γδ poden considerarse un compoñente do sistema inmunitario adaptativo no sentido de que rearranxan os xenes TCR para producir diversidade e desenvolven un fenotipo de memoria inmunolóxica. Porén, poden ser considerados tamén parte do sistema inmunitario innato no sentido de que utilizan uns receptores TCR ou NK restrinxidos que poden ser utilizados como receptores de recoñecemento de patrón. Por exemplo, de acordo con este paradigma, grandes cantidades de células T Vγ9/Vδ2 responden en poucas horas a moléculas comúns (non peptídicas) producidas polos microbios, e as células T Vδ1 intraepiteliais moi restrinxidas responden a células epiteliais estresadas.
Os linfocitos B e a produción de anticorpos
[editar | editar a fonte]- Artigo principal: Célula B.

As células B son as principais células implicadas na creación de anticorpos que circulan no plasma sanguíneo e linfa, o que se denomina inmunidade humoral. Os anticorpos (tamén chamados inmunoglobulinas, Ig), son grandes proteínas con forma de Y utilizadas polo sistema inmunitario para identificar e neutralizar obxectos estraños. En mamíferos hai cinco tipos de anticorpos: IgA, IgD, IgE, IgG, e IgM, con diferentes propiedades biolóxicas, cada un dos cales evolucionou para atacar a diferentes tipos de antíxenos. Despois da súa activación, as células B producen anticorpos, cada un dos cales recoñece un único antíxeno, e neutraliza patóxenos específicos.[1]
As células B presentan na súa superficie copias dun receptor de células B (BCR), que é un anticorpo inmobilizado na membrana. Todos os BCR dun determinado clon de células B recoñécense e únense a só un antíxeno particular. Unha diferenza fundamental entre as células B e as T é o xeito como cada célula "percibe" o antíxeno. As células T recoñecen o seu antíxeno afín en forma procesada (como un fragmento de péptido no contexto dunha molécula MHC á que está unido),[1] mentres que as células B recoñecen os antíxenos na súa forma nativa.[1] Unha vez que unha célula B encontra o seu antíxeno afín ou específico (e recibe sinais adicionais dunha célula T axudante, predominantemente do tipo Th2), seguidamente se diferencia nunha célula efectora, chamada célula plasmática.[1]
As células plasmáticas son células de vida curta (2–3 días) que segregan anticorpos. Estes anticorpos únense aos antíxenos, facendo que estes sexan unha diana máis fácil para os fagocitos, e desencadean a cascada do complemento.[1] Aproximadamente o 10% das células plasmáticas sobreviven para converterse en células B de memoria específicas de antíxeno e de vida longa.[1] Estas células están xa cebadas para producir anticorpos específicos, e poden ser chamadas para responder rapidamente se o mesmo patóxeno reinfecta ao hóspede; de tal xeito que nese caso o hóspede sofre poucos ou nigún síntoma de infección.
Sistema inmunitario adquirido alternativo
[editar | editar a fonte]Aínda que as moléculas clásicas do sistema inmunitario adquirido (como os anticorpos e receptores de células T) existen só nos vertebrados con mandíbula (gnatóstomos), descubriuse tamén un sistema distinto baseado en moléculas derivadas dos linfocitos nos primitivos vertebrados sen mandíbula (ágnatos), como as lampreas e mixinos. Estes animais posúen un gran conxunto de moléculas chamadas receptores de linfocitos variables (VLRs) que, igual que os antíxenos dos vertebrados mandibulados, son produto de só un pequeno número (un ou dous) de xenes. Estas moléculas crese que se unen aos antíxenos dos patóxenos de xeito similar ao dos anticorpos, e co mesmo grao de especificidade.[6]
Memoria inmunolóxica
[editar | editar a fonte]Cando as células B e T se activan, algunhas convértense en células de memoria. Ao longo da vida dun animal estas células de memoria forman unha especie de base de datos de linfocitos B e T efectores preparados para activarse. Cando interaccionan cun antíxeno co que xa se tivera contacto anteriormente, as células de memoria apropiadas son seleccionadas e activadas. Desta maneira, a segunda e subseguintes exposicións a un antíxeno producen unha resposta inmune máis rápida e máis forte. Isto é "adaptativo" porque así o sistema inmunitario do corpo se prepara para futuros retos, pero tamén pode ser "desadaptativo" se os receptores son autoinmunes. A memoria inmunolóxcia pode ser de dous tipos: memoria a curto prazo pasiva ou memoria a longo prazo activa.
Memoria pasiva
[editar | editar a fonte]A memoria pasiva é xeralmente de curto prazo, e dura só de poucos días a varios meses. Por exemplo, os meniños neonatos non tiveron unha exposición anterior a microbios e son particularmente vulnerables ás infeccións, e a nai proporciónalles varios niveis de protección pasiva. No útero, as IgG maternas son transportadas directamente a través da placenta, polo que ao naceren os meniños teñen niveis elevados destes anticorpos, co mesmo rango de especificidades ca os das súas nais.[1] Ademais, o leite humano contén anticorpos que se transfiren ao tracto dixestivo do neno, e protéxeno das infeccións bacterianas ata que o neonato poida sintetizar os seus propios anticorpos.[1]
Esta é unha inmunidade pasiva porque o feto non fabrica os seus anticorpos (nin células de memoria), senón que só os recibe da súa nai. A inmunidade pasiva a curto prazo pode tamén transferirse artificialmente dun individuo a outro administrando anticorpos do soro sanguíneo.
Memoria activa
[editar | editar a fonte]A inmunidade activa é xeralmente a longo prazo e pode adquirirse por unha infección anterior que orixinou a activación de células B e T, ou adquirirse artificialmente por medio da vacinación, nun proceso chamado inmunización.
Inmunización
[editar | editar a fonte]Historicamente, as doenzas infecciosas foron a causa principal de morte nas poboacións humanas. No século XX, desenvolvéronse dous importantes factores que axudaron a combater o seu espallamento; o saneamento e a inmunización.[3] A inmunización (mediante vacinación) é a indución deliberada dunha resposta inmune, e é a manipulación máis efectiva do sistema inmunitario que se ten ideado.[3] As inmunizacións teñen éxito porque utilizan a especificidade natural do sistema inmunitario e a súa inducibilidade.
O principio que está detrás da inmunización é introducir un antíxeno, derivado dun organismo causante dunha enfermidade, que estimula o sistema inmunitario para que desenvolva unha inmunidade protectora contra ese organismo, pero dito antíxeno non causa por si mesmo efectos patóxénicos. Un antíxeno, defínese como calquera substancia que se une a un anticorpo específico e provoca unha resposta inmunitaria adaptativa.[2]
A maioría das vacinas están baseadas en virus vivos atenuados, mentres que moitas vacinas bacterianas están baseadas en compoñentes acelulares dos microorganismos, como compoñentes inofensivos de toxinas.[2] Moitos antíxenos bacterianos derivados de vacinas acelulares non inducen fortemente unha resposta adquirida, e a maioría das vacinas bacterianas requiren a adición de adxuvantes que activan as células presentadoras de antíxenos do sistema inmunitario innato para así potenciar a súa inmunoxenicidade.[3]
Diversidade inmunolóxica
[editar | editar a fonte]A maioría das macromoléculas, incluíndo practicamente a todas as proteínas e moitos polisacáridos, poden funcionar como antíxenos.[1] As partes dun antíxeno que interaccionan cunha molécula de anticorpo ou un receptor de linfocito, denomínanse epitopos. A maioría dos antíxenos conteñen varios epitopos e poden estimular a produción de anticorpos, respostas de células T específicas, ou ambas as cousas.[1]

A un determinado antíxeno só pode unirse unha proporción moi pequena (menos do 0,01%) do total de linfocitos, o cal suxire que só unhas poucas células responden a cada antíxeno.[3]
Para que a resposta adquirida "lembre" e elimine un gran número de patóxenos, o sistema inmunitario debe poder distinguir entre moitos antíxenos diferentes,[2] e os receptores que recoñecen os antíxenos deben ser producidos nun gran número de configuracións, esencialmente un receptor (polo menos) por cada patóxeno diferente co que o corpo se puidese ter encontrado. Mesmo en ausencia de estimulación polo antíxeno, un ser humano pode proiducir máis de 1012 moléculas de anticorpos diferentes.[3] Requiriríanse millóns de xenes para almacenar a información xenética que habería que utilizar para producir estes receptores, pero, o xenoma humano completo contén menos de 25.000 xenes.[7] Por tanto, non pode haber un xene para cada anticorpo ou receptor.
Esta infinidade de receptores prodúcense por medio dun proceso denominado selección clonal.[1][2] Segundo a teoría da selección clonal, no momento do nacemento un animal xera aleatoriamente unha enorme diversidade de linfocitos (cada un dos cales leva un receptor antixénico único) a partir da información codificada nunha pequena familia de xenes. Para xerar cada receptor único, estes xenes sofren un proceso chamado recombinación V(D)J, ou diversificación combinatorial, no cal un segmento xénico se recombina con outros segmentos xénicos para formar un só xene. É este proceso de ensamblaxe o que xera a enorme diversidade de receptores e anticorpos, antes de que o corpo se encontrase cos antíxenos, e permite que o sistema inmunitario responda a unha case ilimitada diversidade de antíxenos.[1] Ao longo da vida dun animal, os linfocitos que poden reaccionar contra os antíxenos cos que un animal se encontre, serán seleccionados activamente, e dirixidos contra calquera cousa que exprese ese antíxeno.
É importante subliñar que as partes innatas e adquiridas do sistema inmunitario funcionan conxuntamente. As armas inmunitarias adquiridas polas células B e T non poderían funcionar sen a colaboración do sistema innato. As células T non son útiles se as células presentadoras de antíxenos non as activan, e as células B precisan da axuda das células T. Por outra parte, o sistema innato sería probablemente superado en moitos casos polos patóxenos sen a acción especializada da resposta inmunitaria adquirida.
Inmunidade adquirida durante o embarazo
[editar | editar a fonte]- Véxase tamén: Inmunotolerancia no embarazo.
A pedra angular do sistema inmunitario é o recoñecemento do "propio" fronte ao "non propio". Por tanto, os mecanismos que protexen o feto humano (que se considera "non propio") dun ataque do sistema inmunitario, son especialmente interesantes. Aínda que non hai unha explicación completa do fenómeno, hai dúas razóns que foron aducidas clasicamente para explicar como se produce a tolerancia do feto polo organismo da nai. A primeira é que o feto ocupa unha porción do corpo protexida por unha barreira que o sistema inmunitario normalmente non patrulla, o útero e placenta.[1] A segunda é que o feto pode promover unha inmunosupresión local na nai, talvez por un proceso de depleción de nutrientes activa.[1] Explicacións máis modernas deste fenómeno de indución de inmunotolerancia é que se expresan glicoproteínas específicas no útero durante o embarazo que suprimen as respostas inmunes uterinas (como explica a hipótese eu-FEDS, Eutherian Fetoembryonic Defense System, Sistema de defensa fetoembriónico de euterios).
Durante o embarazo nos mamíferos vivíparos (todos menos os Monotremas), os retrovirus endóxenos (ERVs) inseridos no xenoma son activados e prodúcense en grandes cantidades durante a implantación do embrión. Actualmente sabemos que estes virus teñen propiedades inmunosupresoras, o que suxire que desempeñan un papel na protección do embrión do sistema inmunitario da súa nai. Ademais, as proteínas de fusión virais aparentemente causan a formación do sincitio placentario[8] para limitar o intercambio de células migratorias entre o embrión en desenvolvemento e o corpo da nai (algo que un epitelio non fai o suficientemente ben, xa que certas células sanguíneas están especializadas en introducirse entre as células epiteliais e atravesalo). Crese que a acción inmunodepresiva era o comportamento inicial normal do virus, similar ao que fai o VIH, outro retrovirus. As proteínas de fusión foron un modo de espallar a infección a outras células simplemente fusionándoas coas infectadas (o VIH tamén o fai). Pénsase que os antepasados dos modernos mamíferos vivíparos evolucionaron despois de que se produciu a infección por estes virus, permitindo ao feto que sobreviva ao sistema inmunitario da nai.
O proxecto xenoma humano encontrou varios miles de retrovirus endóxenos (ERVs) que se clasificaron en 24 familias.[9]
Notas
[editar | editar a fonte]- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 1,18 1,19 1,20 1,21 1,22 1,23 1,24 1,25 1,26 1,27 1,28 Janeway, C.A., Travers, P., Walport, M., and Shlomchik, M.J. (2001). Immunobiology (5th ed.). New York and London: Garland Science. ISBN 0-8153-4101-6..
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., and Walters, P. (2002). Molecular Biology of the Cell (4th ed.). New York and London: Garland Science. ISBN 0-8153-3218-1.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 Janeway C.A., Travers, P., Walport, M., Shlomchik, M.J. (2005). Immunobiology. (6th ed.). Garland Science. ISBN 0-443-07310-4.
- ↑ Microbiology and Immunology On-Line Textbook: USC School of Medicine
- ↑ 5,0 5,1 5,2 The NIAID resource booklet "Understanding the Immune System (pdf)".
- ↑ M.N. Alder, I.B. Rogozin, L.M. Iyer, G.V. Glazko, M.D. Cooper, Z. Pancer (2005). "Diversity and Function of Adaptive Immune Receptors in a Jawless Vertebrate". Science 310 (5756): 1970–1973. PMID 16373579. doi:10.1126/science.1119420.
- ↑ International Human Genome Sequencing Consortium (2004). "Finishing the euchromatic sequence of the human genome". Nature 431 (7011): 931–45. PMID 15496913. doi:10.1038/nature03001.
- ↑ Mi S, Lee X, Li X; et al. (2000). "Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis". Nature 403 (6771): 785–9. PMID 10693809. doi:10.1038/35001608.
- ↑ Luis P. Villarreal (2001). "Persisting Viruses Could Play Role in Driving Host Evolution". ASM News (American Society for Microbiology). Arquivado dende o orixinal o 08 de maio de 2009. Consultado o 09 de abril de 2013.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]| Commons ten máis contidos multimedia sobre: Sistema inmunitario adaptativo |
