COPII
| |
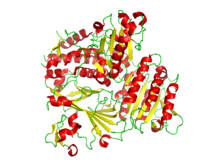
| Diagrama de fitas da estrutura cristalográfica do heterodímero COPII de Sec23 e Sec24. As hélices alfa están en vermello e as follas beta están en amarelo.[1] | |
| Identificadores | |
| Símbolo | SEC23A |
| Entrez | 856311 |
| HUGO | 10701 |
| OMIM | |
| PDB | 1M2V |
| RefSeq | NM_006364 |
| UniProt | Q15436 |
| Outros datos | |
| Locus | Cr. 14 q21.1 |
| Identificadores | |
| Símbolo | SEC24A |
| Entrez | 10802 |
| HUGO | 10703 |
| OMIM | |
| PDB | 1M2V |
| RefSeq | XM_001132082 |
| UniProt | O95486 |
| Outros datos | |
| Locus | Cr. 5 q31.1 |
A COPII (/cop dous/) é un coatómero, un tipo de proteína que forma o recubrimento de vesículas celulares que transportan proteínas desde o retículo endoplasmático rugoso ao aparato de Golgi.[2][3] Este proceso denomínase transporte anterógrado, en contraste co transporte retrógrado asociado coas proteínas COPI (/cop un/). O nome "COPII" procede do inglés coat protein complex II (complexo proteico de cuberta II), que inicia o proceso de evaxinación das vesículas. As vesículas recubertas de COPII denomínanse vesículas COPII. O recubrimento ou revestimento consta de grandes subcomplexos de proteínas que están formados por catro subunidades diferentes.
Proteínas de cuberta
[editar | editar a fonte]O complexo de recubrimento COPII está formado por dous heterodímeros proteicos (en total catro subunidades), que son:
Estas proteínas por si soas non poden causar a evaxinación da vesícula nin dirixir a vesícula á membrana diana correcta. Cómpre tamén a presenza de proteínas SNARE, as proteíns do cargamento e outras proteínas para que este proceso aconteza. Porén, a proteína COPII si causa as unións que forman o revestimento da vesícula, e, por tanto, orixina a súa liberación do retículo endoplasmático. O proceso exacto de como se leva a vesícula ata un lugar determinado, ou de como se determina ese lugar aínda non se coñece.
Proceso de evaxinación
[editar | editar a fonte]A GTPase Sar1p é unha proteína que hidroliza GTP e actúa como un "interruptor" molecular que cambia entre unha forma activa unida a GTP incrustada na membrana e unha forma inactiva unida a GDP soluble.[4] A Sar1p unida a GDP inactiva é atraída ao lado citosólico do retículo endoplasmático. Sec12 é unha proteína transmembrana que se encontra no retículo endoplasmático e actúa como un factor de intercambio do nucleótido de guanina o estimular a liberación de GDP para permitir a unión no seu lugar de GTP. Agora, no estado unido a GTP, Sar1p sofre un cambio conformacional que deixa exposta unha cola hidrofóbica que pode ser inserida na bicapa lipídica, uníndoa á membrana. A Sar1p unida a membrana recruta o complexo Sec23p/24p para formar o que se coñece en conxunto como complexo de preevaxinación. O complexo de preevaxinación recruta o longo e flexible complexo Sec13p/31p. Os complexos Sec13p/31p polimerízanse no lado citosólico da membrana para formar unha estrutura reticulada convexa. A rede que se está a ensamblar causa que a membrana sobresaia cara a fóra ata que a vesícula acaba por evaxinarse. Algunhas proteínas son responsables do empaquetamento selectivo de cargamentos nas vesículas COPII. Por exemplo, Erv29p en Saccharomyces cerevisiae é necesaria para o empaquetamento do factor pro-α glicosilado.[5]
Cambios conformacionais
[editar | editar a fonte]A COPII ten tres sitios específicos de unión nos que se poden formar complexos. A imaxe da dereita (Sed5) presenta o complexo Sec22 t-SNARE unido. Este sitio forma unións máis fortes, polo que é o máis favorecido. (Embo)
Notas
[editar | editar a fonte]- ↑ PDB 3EH1; Mancias JD, Goldberg J (November 2008). "Structural basis of cargo membrane protein discrimination by the human COPII coat machinery". EMBO J. 27 (21): 2918–28. PMC 2580787. PMID 18843296. doi:10.1038/emboj.2008.208.
- ↑ Lee MC, Miller EA (August 2007). "Molecular mechanisms of COPII vesicle formation". Semin. Cell Dev. Biol. 18 (4): 424–34. PMID 17686639. doi:10.1016/j.semcdb.2007.06.007.
- ↑ Hughes H, Stephens DJ (February 2008). "Assembly, organization, and function of the COPII coat". Histochem. Cell Biol. 129 (2): 129–51. PMC 2228377. PMID 18060556. doi:10.1007/s00418-007-0363-x.
- ↑ Bonifacino, Juan S.; Glick, Benjamin S. (2004-01-23). "The mechanisms of vesicle budding and fusion". Cell 116 (2): 153–166. ISSN 0092-8674. PMID 14744428. doi:10.1016/s0092-8674(03)01079-1.
- ↑ Belden WJ and Barlowe C. Role of Erv29p in Collecting Soluble Secretory Proteins into ER-Derived Transport Vesicles. Science. 2011.
- ↑ 6,0 6,1 1PCX; 1PD0; Mossessova E, Bickford LC, Goldberg J (August 2003). "SNARE selectivity of the COPII coat". Cell 114 (4): 483–95. PMID 12941276. doi:10.1016/S0092-8674(03)00608-1.

![Conformación da proteína COPII en complexo coa proteína SNARE Bet1 (PDB 1PCX).[6]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c3/CopIIcomplexbet1.png/240px-CopIIcomplexbet1.png)
![Conformación da proteína COPII en complexo coa proteína SNARE Sed5 (PDB 1PD0).[6]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/52/CopIIcomplexsedt5.png/240px-CopIIcomplexsedt5.png)