Factor de célula nai
| KITLG | |||
|---|---|---|---|
 | |||
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB | ||
| Identificadores | |||
| Símbolos | KITLG (HGNC: 6343) FPH2, FPHH, KL-1, Kitl, MGF, SCF, SF, SHEP7, DCUA, KIT ligand, DFNA69, SLF | ||
| Identificadores externos | |||
| Locus | Cr. 12 qq21.32 | ||
| Padrón de expresión de ARNm | |||
 | |||
 | |||
| Máis información | |||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
O factor de célula nai ou factor de célula troncal, abreviado como SCF (do inglés stem cell factor), tamén chamado ligando KIT (KITLG), ou KL, é unha citocina que se une ao receptor c-KIT (CD117). O SCF pode encontrarse en forma de proteína transmembrana ou como proteína soluble. Esta citocina xoga un importante papel na hematopoese (formación de células sanguíneas), espermatoxénese e melanoxénese.
Produción
[editar | editar a fonte]O xene que codifica o factor de célula nai (SCF) encóntrase no locus Sl do cromosoma 10 do rato e no cromosoma 12 (12q22-12q24) en humanos.[1] As formas soluble e transmembrana da proteína orixínanse por empalme alternativo do mesmo transcrito de ARN,[2][3]

A forma soluble do SCF contén un sitio de clivaxe proteolítica no exón 6 do xene. A clivaxe nese sitio permite que se libere a porción extracelular da proteína. A forma transmembrana do SCF orixínase por un empalme alternativo no que se exclúe o exón 6 (Figura 1). Ambas as forms do SCF únense a c-KIT e son bioloxicamente activas.
Os SCF soluble e transmembrana prodúcenos os fibroblastos e células endoteliais. O SCF soluble ten un peso molecular de 18,5 KDa e forma un dímero. Detéctase no soro sanguíneo humano normal nunha concentración de 3,3 ng/mL.[4]
Papel no desenvolvemento embrionario
[editar | editar a fonte]O SCF exerce un importante papel na hematopoese durante o desenvolvemento embrionario. Os sitios do corpo onde ten lugar a hematopoese, como o fígado fetal e a medula ósea, expresan o SCF. Os ratos que non expresan o SCF morren no útero de anemia grave. Os ratos que non expresan o receptor de SCF (c-KIT) tamén morren de anemia.[5] O SCF pode servir como sinal guía que dirixe as células nai hematopoéticas (HSC, do inglés hematopoietic stem cells) ao seu nicho de célula nai (o microambiente no cal residen as células nai), e xoga un importante papel no mantemento das HSC. Os mutantes puntuais non letais no receptor c-KIT poden causar anemia, diminuír a fertilidade e a pigmentación.[6]
Durante o desenvolvemento a presenza de SCF tamén desempeña un importante papel na localización dos melanocitos, as células que producen a melanina e controlan a pigmentación. Na melanoxénese, os melanoblastos migran desde a crista neural ás localizacións apropiadas da epiderme. Os melanoblastos expresan o receptor KIT e crese que o SCF guía estas células para que cheguen ás súas localizacións finais. O SCF tamén regula a supervivencia e proliferación de melanocitos completamente diferenciados en adultos.[7]
Na espermatoxénese, c-KIT exprésase en células xerminais primordiais e espermatogonias.[8] Tamén se expresa nas células xerminais primordiais das femias. O SCF exprésase ao longo das vías que as células xerminais usan para alcanzar os seus destinos finais no corpo, así como en ditos destinos finais. Igual que cos melanoblastos, isto axuda as células a chegar aos lugares apropiados no corpo.[5]
Papel na hematopoese
[editar | editar a fonte]O SCF desempeña unha función na regulación das HSC no mesmo nicho de célula nai na medula ósea. O SCF incrementa a supervivencia de HSC in vitro e contribúe á autorrenovación e mantemento de ditas células in vivo. As HSC en todos os estadios de desenvolvemento expresan os mesmos niveis de receptor para o SCF (c-KIT).[9] As células estromáticas que rodean as HSC son un compoñente do nicho das células nai, e liberan diversos ligandos, incluíndo o SCF.
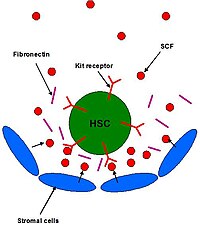
Na medula ósea as HSC e as células proxenitoras hematopoéticas están adxacentes a células estromáticas, como fibroblastos e osteoblastos (Figura 2). Estas HSC prmanecen no nicho adheríndose a proteínas da matriz extracelular e ás propias células estromáticas. O SCF incrementa a adhesión e así pode xogar un importante papel para asegurar que as HSC permanecen no nicho.[5]
Unha pequena porcentaxe de HSC abandona regularmente a medula ósea para entrar na circulación sanguínea e despos torna aos seus nichos na medula ósea.[10] Pénsase que os gradientes de concentración de SCF, xunto coa quimiocina SDF-1, permiten que a HSC encontre o seu camiño de volta cara ao nicho.[11]
No rato adulto, a inxección do anticorpo ACK2 anti-KIT, que se une e inactiva o receptor c-Kit, orixina graves problemas na hematopoese. Causa un significativo decrecemento no número de HSC e outras células proxenitoras hematopoéticas na medula ósea.[12] Isto suxire que o SCF e c-Kit xoga un importante papel na función hematopoética na idade adulta. O SCF tamén incrementa a supervivencia de varios tipos de células proxenitoras hematopoéticas, como proxenitores dos megacariocitos, in vitro.[13] Ademais, funciona con outras citocinas apoiando o crecemento de colonias de BFU-E, CFU-GM e CFU-GEMM4. As células proxenitoras hematopoéticas migran cara á zona do gradiente onde hai maior concentración de SCF in vitro, o que indica que o SCF está implicado na quimiotaxe nestas células.
As HSC fetais son máis sensibles ao SCF que as HSC de adultos. De feito, as HSC fetais en cultivo celular son 6 veces máis sensibles ao SCF que as HSC adultas baseándose na concentración que permite unha supervivencia máxima.[14]
Expresión en mastocitos
[editar | editar a fonte]Os mastocitos son as únicas células hematopoéticas diferenciadas terminalmente que expresan o receptor c-Kit. Os ratos con mutacións en SCF ou c-Kit teñen graves defectos na produción de mastocitos, e presentan niveis de menos do 1% dos niveis normais de mastocitos. Inversamente, a inxección de SCF multiplica por cen a cantidade de mastocitos preto do sitio de inxección. Ademais, o SCF promove a adhesión de mastocitos, migración, proliferación e supervivencia.[15] Tamén promove a liberación de histamina e triptase, que están implicadas na resposta alérxica.
Formas soluble e transmembrana
[editar | editar a fonte]Cómpre a presenza de tanto as formas solubles coma as transmembrana do SCF para a función hematopoética normal.[2][16] Os ratos que producen o SCF soluble pero non o SCF transmembrana padecen anemia, son estériles e carecen de pigmentación. Isto suxire que o SCF transmembrana xoga un papel especial in vivo separado do da forma soluble.
Receptor c-KIT
[editar | editar a fonte]- Artigo principal: CD117.

O SCF únese ao receptor c-KIT (CD 117), unha receptor tirosina quinase.[17] c-Kit exprésase en HSC, mastocitos, melanocitos, e células xerminais. Tamén se expresan en células proxenitoras hematopoéticas incluíndo eritroblastos, mieloblastos e megacariocitos. Porén, coa excepción dos mastocitos, a expresión diminúe a medida que estas células hematopoéticas van madurando e o c-KIT xa non se expresa cando as células están completamente diferenciadas (Figura 3). A unión de SCF a c-KIT causa que o receptor se homodimerice e se autofosforile en residos de tirosina. A activación de c-Kit causa a activación de múltiples fervenzas de sinalización, como as vías RAS/ERK, PI3-quinase, Src quinase e JAK/STAT.[17]
Importancia clínica
[editar | editar a fonte]O SCF pode utilizarse xunto con outras citocinas para cultivar células nai hematopoéticas e células proxenitoras hematopoéticas. A expansión destas células ex-vivo (fóra do corpo) podería ser un avance no transplante de medula ósea, no cal as HSC se transfiren a un paciente para restablecer a formación de sangue.[9] Un dos problemas de inxectar SCF con propósitos terapéuticos é que o SCF activa os mastocitos. A inxección do SCF causa síntomas similares á alerxia e á proliferación de mastocitos e melanocitos.[5]
A sobreexpresión específica de cardiomiocitos do SCF transmembrana promove a migración de células nai e mellora a función cardíaca e a supervivencia animal despois dun infarto de miocardio.[18]
Interaccións
[editar | editar a fonte]O factor de célula nai interacciona con CD117.[19][20]
Notas
[editar | editar a fonte]- ↑ Geissler EN, Liao M, Brook JD, Martin FH, Zsebo KM, Housman DE, Galli SJ (March 1991). "Stem cell factor (SCF), a novel hematopoietic growth factor and ligand for c-kit tyrosine kinase receptor, maps on human chromosome 12 between 12q14.3 and 12qter". Somat. Cell Mol. Genet. 17 (2): 207–14. PMID 1707188. doi:10.1007/BF01232978.
- ↑ 2,0 2,1 Flanagan JG, Chan DC, Leder P (March 1991). "Transmembrane form of the kit ligand growth factor is determined by alternative splicing and is missing in the Sld mutant". Cell 64 (5): 1025–35. PMID 1705866. doi:10.1016/0092-8674(91)90326-t.
- ↑ Anderson DM, Williams DE, Tushinski R, Gimpel S, Eisenman J, Cannizzaro LA, Aronson M, Croce CM, Huebner K, Cosman D (August 1991). "Alternate splicing of mRNAs encoding human mast cell growth factor and localization of the gene to chromosome 12q22-q24". Cell Growth Differ. 2 (8): 373–8. PMID 1724381.
- ↑ Langley KE, Bennett LG, Wypych J, Yancik SA, Liu XD, Westcott KR, Chang DG, Smith KA, Zsebo KM (February 1993). "Soluble stem cell factor in human serum". Blood 81 (3): 656–60. PMID 7678995.
- ↑ 5,0 5,1 5,2 5,3 Broudy VC (August 1997). "Stem cell factor and hematopoiesis". Blood 90 (4): 1345–64. PMID 9269751.
- ↑ Blouin R, Bernstein A (1993). "The White spotting and Steel hereditary anaemias of the mouse". En Freedman MH, Feig SA. Clinical disorders and experimental models of erythropoietic failure. Boca Raton: CRC Press. ISBN 0-8493-6678-X.
- ↑ Wehrle-Haller B (June 2003). "The role of Kit-ligand in melanocyte development and epidermal homeostasis". Pigment Cell Res. 16 (3): 287–96. PMID 12753403. doi:10.1034/j.1600-0749.2003.00055.x.
- ↑ Rossi P, Sette C, Dolci S, Geremia R (October 2000). "Role of c-kit in mammalian spermatogenesis". J. Endocrinol. Invest. 23 (9): 609–15. PMID 11079457. doi:10.1007/bf03343784.
- ↑ 9,0 9,1 Kent D, Copley M, Benz C, Dykstra B, Bowie M, Eaves C (April 2008). "Regulation of hematopoietic stem cells by the steel factor/KIT signaling pathway". Clin. Cancer Res. 14 (7): 1926–30. PMID 18381929. doi:10.1158/1078-0432.CCR-07-5134.
- ↑ Méndez-Ferrer S, Lucas D, Battista M, Frenette PS (March 2008). "Haematopoietic stem cell release is regulated by circadian oscillations". Nature 452 (7186): 442–7. PMID 18256599. doi:10.1038/nature06685.
- ↑ Nervi B, Link DC, DiPersio JF (October 2006). "Cytoknes and hematopoietic stem cell mobilization". J. Cell. Biochem. 99 (3): 690–705. PMID 16888804. doi:10.1002/jcb.21043.
- ↑ Ogawa M, Matsuzaki Y, Nishikawa S, Hayashi S, Kunisada T, Sudo T, Kina T, Nakauchi H, Nishikawa S (July 1991). "Expression and function of c-kit in hemopoietic progenitor cells". J. Exp. Med. 174 (1): 63–71. PMC 2118893. PMID 1711568. doi:10.1084/jem.174.1.63.
- ↑ Keller JR, Ortiz M, Ruscetti FW (September 1995). "Steel factor (c-kit ligand) promotes the survival of hematopoietic stem/progenitor cells in the absence of cell division". Blood 86 (5): 1757–64. PMID 7544641.
- ↑ Bowie MB, Kent DG, Copley MR, Eaves CJ (June 2007). "Steel factor responsiveness regulates the high self-renewal phenotype of fetal hematopoietic stem cells". Blood 109 (11): 5043–8. PMID 17327414. doi:10.1182/blood-2006-08-037770.
- ↑ Okayama Y, Kawakami T (2006). "Development, migration, and survival of mast cells". Immunol. Res. 34 (2): 97–115. PMC 1490026. PMID 16760571. doi:10.1385/IR:34:2:97.
- ↑ Brannan CI, Lyman SD, Williams DE, Eisenman J, Anderson DM, Cosman D, Bedell MA, Jenkins NA, Copeland NG (June 1991). "Steel-Dickie mutation encodes a c-kit ligand lacking transmembrane and cytoplasmic domains". Proc. Natl. Acad. Sci. U.S.A. 88 (11): 4671–4. PMC 51727. PMID 1711207. doi:10.1073/pnas.88.11.4671.
- ↑ 17,0 17,1 Rönnstrand L (October 2004). "Signal transduction via the stem cell factor receptor/c-Kit". Cell. Mol. Life Sci. 61 (19-20): 2535–48. PMID 15526160. doi:10.1007/s00018-004-4189-6.
- ↑ Xiang FL, Lu X, Hammoud L, Zhu P, Chidiac P, Robbins J, Feng Q (September 2009). "Cardiomyocyte-specific overexpression of human stem cell factor improves cardiac function and survival after myocardial infarction in mice". Circulation 120 (12): 1065–74, 9 p following 1074. PMID 19738140. doi:10.1161/CIRCULATIONAHA.108.839068.
- ↑ Lev S, Yarden Y, Givol D (May 1992). "A recombinant ectodomain of the receptor for the stem cell factor (SCF) retains ligand-induced receptor dimerization and antagonizes SCF-stimulated cellular responses". J. Biol. Chem. 267 (15): 10866–73. PMID 1375232.
- ↑ Blechman JM, Lev S, Brizzi MF, Leitner O, Pegoraro L, Givol D, Yarden Y (Feb 1993). "Soluble c-kit proteins and antireceptor monoclonal antibodies confine the binding site of the stem cell factor". J. Biol. Chem. 268 (6): 4399–406. PMID 7680037.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Lennartsson J, Rönnstrand L (2012). "Stem cell factor receptor/c-Kit: from basic science to clinical implications". Physiol. Rev. 92 (4): 1619–49. PMID 23073628. doi:10.1152/physrev.00046.2011.
- Broudy VC (1997). "Stem cell factor and hematopoiesis". Blood 90 (4): 1345–64. PMID 9269751.
- Andrews RG, Briddell RA, Appelbaum FR, McNiece IK (1994). "Stimulation of hematopoiesis in vivo by stem cell factor". Curr. Opin. Hematol. 1 (3): 187–96. PMID 9371281.
- Wehrle-Haller B (2003). "The role of Kit-ligand in melanocyte development and epidermal homeostasis". Pigment Cell Res. 16 (3): 287–96. PMID 12753403. doi:10.1034/j.1600-0749.2003.00055.x.
- Rönnstrand L (2004). "Signal transduction via the stem cell factor receptor/c-Kit". Cell. Mol. Life Sci. 61 (19-20): 2535–48. PMID 15526160. doi:10.1007/s00018-004-4189-6.
- Mroczko B, Szmitkowski M (2004). "Hematopoietic cytokines as tumor markers". Clin. Chem. Lab. Med. 42 (12): 1347–54. PMID 15576295. doi:10.1515/CCLM.2004.253.
- Lev S, Yarden Y, Givol D (1992). "A recombinant ectodomain of the receptor for the stem cell factor (SCF) retains ligand-induced receptor dimerization and antagonizes SCF-stimulated cellular responses". J. Biol. Chem. 267 (15): 10866–73. PMID 1375232.
- Huang EJ, Nocka KH, Buck J, Besmer P (1992). "Differential expression and processing of two cell associated forms of the kit-ligand: KL-1 and KL-2". Mol. Biol. Cell 3 (3): 349–62. PMC 275535. PMID 1378327. doi:10.1091/mbc.3.3.349.
- Toyota M, Hinoda Y, Itoh F, Tsujisaki M, Imai K, Yachi A (1992). "Expression of two types of kit ligand mRNAs in human tumor cells". Int. J. Hematol. 55 (3): 301–4. PMID 1379846.
- Lu HS, Clogston CL, Wypych J, Parker VP, Lee TD, Swiderek K, Baltera RF, Patel AC, Chang DC, Brankow DW (1992). "Post-translational processing of membrane-associated recombinant human stem cell factor expressed in Chinese hamster ovary cells". Arch. Biochem. Biophys. 298 (1): 150–8. PMID 1381905. doi:10.1016/0003-9861(92)90106-7.
- Sharkey A, Jones DS, Brown KD, Smith SK (1992). "Expression of messenger RNA for kit-ligand in human placenta: localization by in situ hybridization and identification of alternatively spliced variants". Mol. Endocrinol. 6 (8): 1235–41. PMID 1383693. doi:10.1210/mend.6.8.1383693.
- Mathew S, Murty VV, Hunziker W, Chaganti RS (1992). "Subregional mapping of 13 single-copy genes on the long arm of chromosome 12 by fluorescence in situ hybridization". Genomics 14 (3): 775–9. PMID 1427906. doi:10.1016/S0888-7543(05)80184-3.
- Geissler EN, Liao M, Brook JD, Martin FH, Zsebo KM, Housman DE, Galli SJ (1991). "Stem cell factor (SCF), a novel hematopoietic growth factor and ligand for c-kit tyrosine kinase receptor, maps on human chromosome 12 between 12q14.3 and 12qter". Somat. Cell Mol. Genet. 17 (2): 207–14. PMID 1707188. doi:10.1007/BF01232978.
- Anderson DM, Williams DE, Tushinski R, Gimpel S, Eisenman J, Cannizzaro LA, Aronson M, Croce CM, Huebner K, Cosman D (1991). "Alternate splicing of mRNAs encoding human mast cell growth factor and localization of the gene to chromosome 12q22-q24". Cell Growth Differ. 2 (8): 373–8. PMID 1724381.
- Martin FH, Suggs SV, Langley KE, Lu HS, Ting J, Okino KH, Morris CF, McNiece IK, Jacobsen FW, Mendiaz EA (1990). "Primary structure and functional expression of rat and human stem cell factor DNAs". Cell 63 (1): 203–11. PMID 2208279. doi:10.1016/0092-8674(90)90301-T.
- Ramenghi U, Ruggieri L, Dianzani I, Rosso C, Brizzi MF, Camaschella C, Pietsch T, Saglio G (1994). "Human peripheral blood granulocytes and myeloid leukemic cell lines express both transcripts encoding for stem cell factor". Stem Cells 12 (5): 521–6. PMID 7528592. doi:10.1002/stem.5530120508.
- Saito S, Enomoto M, Sakakura S, Ishii Y, Sudo T, Ichijo M (1994). "Localization of stem cell factor (SCF) and c-kit mRNA in human placental tissue and biological effects of SCF on DNA synthesis in primary cultured cytotrophoblasts". Biochem. Biophys. Res. Commun. 205 (3): 1762–9. PMID 7529021. doi:10.1006/bbrc.1994.2873.
- Laitinen M, Rutanen EM, Ritvos O (1995). "Expression of c-kit ligand messenger ribonucleic acids in human ovaries and regulation of their steady state levels by gonadotropins in cultured granulosa-luteal cells". Endocrinology 136 (10): 4407–14. PMID 7545103. doi:10.1210/endo.136.10.7545103.
- Blechman JM, Lev S, Brizzi MF, Leitner O, Pegoraro L, Givol D, Yarden Y (1993). "Soluble c-kit proteins and antireceptor monoclonal antibodies confine the binding site of the stem cell factor". J. Biol. Chem. 268 (6): 4399–406. PMID 7680037.
- Lu HS, Jones MD, Shieh JH, Mendiaz EA, Feng D, Watler P, Narhi LO, Langley KE (1996). "Isolation and characterization of a disulfide-linked human stem cell factor dimer. Biochemical, biophysical, and biological comparison to the noncovalently held dimer". J. Biol. Chem. 271 (19): 11309–16. PMID 8626683. doi:10.1074/jbc.271.19.11309.
- Vanhaesebroeck B, Welham MJ, Kotani K, Stein R, Warne PH, Zvelebil MJ, Higashi K, Volinia S, Downward J, Waterfield MD (1997). "P110delta, a novel phosphoinositide 3-kinase in leukocytes". Proc. Natl. Acad. Sci. U.S.A. 94 (9): 4330–5. PMC 20722. PMID 9113989. doi:10.1073/pnas.94.9.4330.
Ligazóns externas
[editar | editar a fonte]- Stem cell factor Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- http://www.genome.jp/dbget-bin/show_pathway?hsa04640+4254 - KEGG pathway: Hematopoietic cell lineage
