Luciferina do vagalume
| Luciferina do vagalume | |
|---|---|
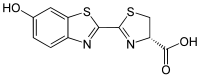 | |
Ácido (4S)-2-(6-hidroxi-1,3-benzotiazol-2-il)-4,5-dihidrotiazol-4-carboxílico | |
Outros nomes D-(-)-Luciferina | |
| Identificadores | |
| Número CAS | 2591-17-5 |
| PubChem | 5484207 |
| ChemSpider | 4588411, 16735812 Unha das representacións tautoméricas |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C11H8N2O3S2 |
| Masa molar | 280,32 g mol−1 |
| Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |

A luciferina do vagalume[1][2] é unha molécula do tipo das luciferinas que emite luz, que se atopa en moitas especies de insectos da familia Lampyridae, como os vagalumes. É o substrato do encima luciferase (número EC 1.13.12.7), responsable da emisión de luz amarela característica destes animais. Igual que nas outras luciferinas, requírese oxíxeno para a produción de luz, e tamén se necesitan ATP e magnesio.[3][4]
Historia
[editar | editar a fonte]A maior parte dos traballos iniciais sobre a química da bioluminescencia dos vagalumes fíxose no laboratorio de William D. McElroy na Universidade Johns Hopkins. A luciferina foi illada e purificada en 1949, aínda que pasaron varios anos ata que se desenvolveu un procedemento para cristalizar o composto con alto rendemento. Isto, xunto coa síntese e dilucidación da súa estrutura, foi realizado por Emil H. White na Universidade Johns Hopkins.[5] O procedemento foi unha extracción ácido-base, dada a presenza dun grupo carboxílo na luciferina. Para a súa extracción utilizouse etil acetato a pH baixo a partir do po de aproximadamente uns 15.000 vagalumes.[6] A estrutura foi máis tarde confirmada polo uso combinado de espectroscopía infravermella, espectroscopía de luz utravioleta visible e métodos sintéticos para degradar o composto en fragmentos identificables.[7]
Propiedades
[editar | editar a fonte]A luciferina cristalizada era fluorescente, e absorbía luz ultravioleta cun pico de absorción aos 327 nm e emitía luz cun pico aos 530 nm. As solucións alcalinas causaban un corremento ao vermello na absorción probablemente debido á desprotonación do grupo hidroxilo do benzotiazol, pero non afectaba á emisión fluorescente. Encontrouse que o luciferil adenilato (o éster de AMP da luciferina) emite espontaneamente luz en solución.[8] Diferentes especies de vagalumes usan a mesma luciferina, pero a cor da luz emitida pode ser distinta. A luz de Photuris pennsylvanica emite a 552 nm (amarelo verdoso) pero Pyrophorus plagiophthalamus emite a 582 nm (laranxa) no órgano ventral. As femias de Lampyris noctiluca emiten luz amarelo verdosa. Estas diferenzas débense probablemente a cambios de pH ou diferenzas na estrutura primaria do encima luciferase.[9]
Biosíntese
[editar | editar a fonte]A síntese in vivo da luciferina do vagalume non se comprende totalmente. Só foron estudados os pasos finais da ruta encimática, que é unha reacción de condensación de D-cisteína con 2-ciano-6-hidroxibenzotiazol, e é a mesma reacción utilizada para producir o composto sinteticamente.[10] Isto foi confirmado por etiquetado isotópico de átomos nos dous compostos e pola identificación dun encima rexenerador da luciferina.[11]
Notas
[editar | editar a fonte]- ↑ PubChem compound
- ↑ ChemSpider [1] Tautómeros.
- ↑ McElroy WD (1947). "The Energy Source for Bioluminescence in an Isolated System.". Proc Natl Acad Sci USA 33 (11): 342–345. PMC 1079070. PMID 16588763. doi:10.1073/pnas.33.11.342.
- ↑ Green A, McElroy WD (1956). "Function of adenosine triphosphate in the activation of luciferin.". Arch Biochem Biophys 64 (2): 257–271. PMID 13363432. doi:10.1016/0003-9861(56)90268-5.
- ↑ Strehler BL, McElroy WD (1949). "Purification of firefly luciferin.". J Cell Physiol 34 (3): 457–466. PMID 15406363. doi:10.1002/jcp.1030340310.
- ↑ Bitler B, McElroy WD (1957). "The Preparation and Properties of Crystalline Firely Luciferin". Arch Biochem Biophys 72 (2): 358–368. PMID 13479120. doi:10.1016/0003-9861(57)90212-6.
- ↑ White EH, McCapra F, Field GF, and McElroy WD (1961). "The Structure and Synthesis of Firefly Luciferin". J Am Chem Soc 83 (10): 2402–2403. doi:10.1021/ja01471a051.
- ↑ Rhodes WC, McElroy WD (1958). "The synthesis and function of luciferyl-adenylate and oxyluciferyl-adenylate.". J Biol Chem 233 (6): 1528–1537. PMID 13610868.
- ↑ Seliger HH, Buck JB, Fastie WG, McElroy WD (1964). "The Spectral Distribution of Firefly Light.". J Gen Physiol 48 (1): 95–104. PMC 2195396. PMID 14212153. doi:10.1085/jgp.48.1.95.
- ↑ White EH, Worther H, Field GF, and McElroy WD (1965). "Analogs of Firefly Luciferin.". J. Org. Chem. 30 (7): 2344–2348. doi:10.1021/jo01018a054.
- ↑ Gomi K, Kajiyama N (2001). "Oxyluciferin, a Luminescence Product of Firefly Luciferase, Is Enzymatically Regenerated into Luciferin.". J Biol Chem 276 (39): 36508–36513. PMID 11457857. doi:10.1074/jbc.M105528200. Arquivado dende o orixinal o 06 de novembro de 2008. Consultado o 24 de xuño de 2012.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Bioluminescencia cos principais tipos de luciferina
