Interferencia de ARN
Suxeriuse que este artigo ou apartado sexa fusionado con "ARN interferente" (conversa). Para realizar a fusión das páxinas segue estes pasos. |

A interferencia de ARN ou interferencia por ARN ou ribointerferencia, abreviada como RNAi (do inglés RNA interference), é un sistema celular que intervén no control da inactivación dos xenes e do seu grao de expresión, que é realizado por certos tipos de ARN, chamados ARN interferentes. Por tanto, cómpre distinguir entre:
- Interferencia de ARN (ou RNAi, RNA interference). É o proceso biolóxico antes mencionado.
- ARN interferentes (ou iRNA, interferring RNA). Son certos tipos de ARN encargados de realizar ese proceso biolóxico.
Historicamente a interferencia de ARN foi coñecida tamén con outros nomes, como cosupresión, silenciamento de xenes postranscricional (PTGS), e quelling.
Hai dous tipos de moléculas de ARN pequenas, o microARN (miRNA) e o ARN interferente pequeno (siRNA), que son básicos na interferencia de ARN. Outro tipo de ARN interferente é o piRNA (asociado ás proteínas piwi). Os ARN son un produto directo da transcrición de xenes, e estes pequenos ARN poden unirse a outros ARN específicos (ARNm) facendo que aumenten ou diminúan a súa actividade; por exemplo impedindo que o ARNm sexa traducido a proteínas. A interferencia de ARN ten un importante papel na defensa das células contra xenes parasitos, como virus e transposóns, pero tamén dirixen o desenvolvemento celular e a expresión xenética en xeral.
A vía da interferencia de ARN (RNAi) está presente nos animais e en moitos eucariotas e iníciase polo encima Dicer, que corta os ARN de dobre cadea (dsRNA, double stranded RNA) longos en fragmentos máis curtos de ~20 nucleótidos que se chaman siRNA. Cada siRNA sepárase en dúas cadeas de ARN monocatenarias (ssRNA, single stranded RNA), que se denominan a fibra pasaxeira e a fibra guía. A fibra pasaxeira será degradada, e a fibra guía será incorporada no chamado complexo silenciador inducido por ARN (RISC, RNA-induced silencing complex). O fenómeno de interferencia mellor estudado é o silenciamento de xenes postranscricional, que ocorre cando a fibra guía se une por apareamento de bases cunha secuencia complementaria dunha molécula de ARN mensaxeiro e induce o seu corte pola Argonauta, o compoñente catalítico do complexo RISC. Este proceso sábese que se propaga sistemicamente a través do organismo a pesar da limitada concentración molar inicial do siRNA.
O efecto selectivo e potente da interferencia de ARN (RNAi) sobre a expresión xénica fai deste proceso unha ferramenta valiosa para a investigación tanto en cultivos celulares coma nos organismos vivos, porque os ARN de dobre cadea introducidos nas células poden inducir a supresión dos xenes específicos que interesen. A interferencia (RNAi) pode tamén utilizarse en exames a grande escala que bloqueen sistematicamente a expresión de cada xene dunha célula, o cal pode axudar a identificar os compoñentes que se precisan para cada proceso celular ou para procesos complexos como a división celular. O aproveitamento desta vía é tamén unha ferramenta moi prometedora en biotecnoloxía e medicina.
Historicamente, a interferencia de ARN era coñecida por outros nomes, como cosupresión, silenciamento de xenes postranscricional, e sufocamento (quelling). Só despois de que se comprendesen ben estes procesos aparentemente non relacionados quedou claro que todos eles describían o mesmo fenómeno, a interferencia de ARN (RNAi). En 2006, Andrew Fire e Craig C. Mello compartiron o Premio Nobel de Medicina e Fisioloxía polos seus traballos publicados en 1998 sobre a interferencia de ARN no verme nematodo Caenorhabditis elegans [1][2].
Mecanismo celular
[editar | editar a fonte]
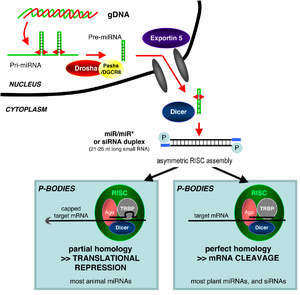
A RNAi é un proceso de silenciamento de xenes dependente do ARN que está controlado polo complexo silenciador inducido por ARN (RISC) e é iniciado por moléculas curtas de ARN de dobre cadea (dsRNA) no citoplasma celular, onde interaccionan co compoñente catalítico de RISC, chamado Argonauta.[1] Cando o ARN bicatenario (dsRNA) é de procedencia exóxena (procede da infección dun virus con xenoma de ARN ou de manipulacións de laboratorio), o ARN impórtase directamente ao citoplasma e córtase en fragmentos polo encima Dicer. Pero o dsRNA iniciador pode ser tamén endóxeno (orixinado dentro da célula), como pode ser un pre-microARN expresado a partir dun xene codificante de ARN do xenoma. Os transcritos primarios de cada xene son primeiro procesados para formar a característica estrutura de talo-bucle dos pre-microARN que se encontran no núcleo celular, despois son exportados ao citoplasma para ser escindidos por Dicer. Así, as dúas vías do ARN de dobre cadea, exóxena e endóxena, converxen no complexo RISC.[4]
Escisión dos ARN bicatenarios
[editar | editar a fonte]Os ARN bicatenarios endóxenos inician a interferencia de ARN activando a ribonuclease Dicer,[5] que se une e corta os ARN de dobre cadea (dsRNA), orixinando fragmentos de dobre cadea de 20–25 pares de bases con 2 nucleótidos máis que sobresaen nos extremos 3'.[6][7][8][9] Estudos bioinformáticos dos xenomas de múltiples organismos suxiren que esta lonxitude maximiza a especificidade co xene diana e minimiza os efectos non específicos.[10] Estes curtos fragmentos de ARN bicatenario denomínanse ARN interferentes pequenos (siRNA). Estes siRNA son despois separados en moléculas monocatenarias e integradas nun complexo RISC activo. Despois da integración no RISC, os siRNA únense por apareamento de bases complementarias ao seu ARNm diana e inducen o corte de dito ARNm, impedindo dese modo que poida ser utilizado como molde para a tradución de proteinas.[11]
Os ARN de dobre cadea exóxenos son detectados por unha proteína efectora que se une a eles, chamada RDE-4 no verme Caenorhabditis elegans e R2D2 na mosca Drosophila, que estimula a actividade de Dicer.[12] Esta proteína só se une a ARN bicatenarios longos, mais o mecanismo que determina esta especificidade de tamaño é descoñecido.[12] Esta proteína de unión ao ARN entón facilita a transferencia dos siRNA cortados ao complexo RISC.[13]
En C. elegans, esta resposta de iniciación amplifícase por medio da síntese dunha poboación de siRNA "secundarios" durante a cal os siRNA iniciadores producidos polo Dicer ou siRNA "primarios" son utilizados como moldes.[14] Estes siRNA "secundarios" son estruturalmente distintos dos producidos polo Dicer e parece que son producidos por unha ARN polimerase dependente de ARN (RdRP).[15][16]
MicroARN
[editar | editar a fonte]
- Artigo principal: MicroARN.
Os microARN (miARN) son ARN non codificantes (non codifican proteínas) codificados xenomicamente (transcríbense de xenes do xenoma) que axudan a regular a expresión xénica, particularmente durante o desenvolvemento.[17][18] O fenómeno da interferencia de ARN (RNAi), definida de modo xeral, inclúe os efectos de slenciamento de xenes inducidos endoxenamente polos miRNA e tamén o silenciamento desencadeado polos ARN de dobre cadea alleos. Os microARN maduros son estruturalmente similares aos siRNA producidos a partir de ARN bicatenario exóxeno, pero antes de chegaren á súa maduración, os microARN deben primeiro sufrir unha extensa modificación postranscricional. Un microARN exprésase a partir dun xene codificante de ARN moito mís longo como un transcrito primario coñecido como pri-miRNA que é despois procesado polo complexo microproceador no núcleo celular, orixinando unha estrutura talo-bucle de 70 nucleótidos chamada pre-miRNA. Este complexo consta dun encima RNase III chamado Drosha e unha proteína de unión a ARN bicatenarios chamada Pasha. A porción de dsRNA deste pre-miRNA únese a Dicer, que a corta producindo a molécula madura de microARN que pode integrarse no complexo RISC; deste xeito, os microARN e os siRNA comparten a mesma maquinaria celular nas fases posteriores ao seu procesamento inicial.[19]
Os siRNA derivados de precursores longos de ARN bicatenario (dsRNA) difiren dos microARN en que os microARN, especialmente os de animais, presentan normalmente unha complementariedade de bases incompleta coa súa diana e inhiben a tradución de moitos ARNm diferentes que teñan secuencias similares. Polo contrario, os siRNA normalmente teñen unha complementariedade de bases perfecta e inducen a escisión dun só ARNm diana específico.[20] En Drosophila e C. elegans, os microARN e os siRNA son procesados por distintas proteínas Argonauta e encimas Dicer.[21][22]

Activación do RISC e catálise
[editar | editar a fonte]Os compoñentes activos do complexo silenciador inducido por ARN (RISC) son unhas endonucleases chamadas proteínas argonauta, que cortan a cadea de ARNm diana complementaria en bases do siRNA que se une a ela.[1] Como os fragmentos producidos por Dicer son de dobre cadea, poderían en teoría producir cada unha un siRNA funcional. Porén, só unha das dúas cadeas, a denominada fibra ou cadea guía, se une á proteína argonauta e dirixe o silenciamento xénico. A outra, chamada fibra ou cadea anti-guía ou cadea pasaxeira é degradada durante a activación do RISC.[23] Aínda que se cría inicialmente que unha helicase dependente do ATP separaba estas dúas cadeas,[24] en realidade o proceso é independente do ATP e é realizado directamente polos compoñentes proteicos de RISC.[25][26] A cadea seleccionada como guía tende a ser aquela cuxo extremo 5' está apareado de forma menos estable co seu complemento,[27] pero a selección da cadea non se ve afectada pola dirección na que Dicer corta o ARN bicatenario antes da incorporación de RISC.[28] En vez diso, a proteína R2D2 pode servir como o factor de diferenciación ao unirse o extremo 5', máis estable, da cadea pasaxeira.[29]
A base estrutural da unión do ARN á proteína argonauta foi examinada por cristalografía de raios X do dominio de unión dunha proteína argonauta unida a ARN. Nel, o extremo 5' fosforilado da cadea de ARN entra nun sitio de unión de superficie básica conservado e toma contacto por medio dun catión divalente (con dúas cargas positivas) como o magnesio e por amontoamento (stacking) aromático (un proceso que permite que máis dun átomo comparta un mesmo electrón) entre o nucleótido 5' do siRNA e un residuo conservado de tirosina da proteína. Este sitio crese que forma un sitio de nucleación para a unión do siRNA ao seu ARNm diana.[30]
Non se comprende como o complexo RISC activado localiza os ARNm complementarios na célula. Aínda que se propuxo que o proceso de corte está ligado á tradiución, a tradución do ARNm diana non é esencial para a degradación mediada por interferencia de ARN (RNAi).[31] De feito, a RNAi pode ser máis efectiva contra os ARNm diana que non son traducidos.[32] As proteínas argonauta, o compoñente catalítico do RISC, están localizadas en rexións específicas do citoplasma chamadas corpos P (tamén denominados corpos citoplasmáticos ou corpos GW), que son rexións con alto grao de degradación de ARNm;[33] a actividade dos microARN está tamén agrupada nos corpos P.[34] A distorsión dos corpos P fai decrecer a eficiencia da interferencia de ARN, o que suxire que son o lugar onde se produce unha fase crítica do proceso da interferencia (RNAi).[35]
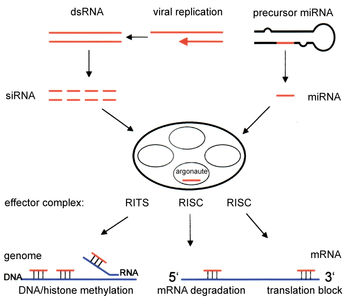
Silenciamento transcricional
[editar | editar a fonte]Compoñentes da vía da interferencia de ARN tamén son utilizados en moitos eucariotas no mantemento da organización e estrutura do xenoma. A modificación de histonas e a indución asociada da formación de heterocromatina serve para diminuír a expresión de xenes pre-transcricionalmente;[37] este proceso denomínase silenciamento transcricional inducido por ARN (RITS), e lévao a cabo un complexo de proteínas chamado o complexo RITS. Nos lévedos de xemación este complexo contén os seguintes elementos: argonauta, unha proteína Chp1 cromodominio, e unha proteína chamada Tas3 de función descoñecida.[38] Como consecuencia, a indución e propagación de rexións de heterocromatina require a presenza de argonauta e proteínas RdRP (ARN polimerse dependente de ARN).[39] A deleción destes xenes no lévedo de xemación S. pombe distorsiona a metilación de histonas e a formación do centrómero,[40] causando que a anafase sexa lenta ou quede estancada durante a división celular.[41] Nalgúns casos, foron observados procesos regulatorios similares asociados coa modificación de histonas que producían o incremento transcricional da expresión xénica.[42]
O mecanismo polo cal o complexo RITS induce a formación e organización da heterocromatina non se coñece ben, e a maioría dos traballos están enfocados o estudo da "rexión tipo apareamento" (mating-type region) dos lévedos de xemación, o cal pode non ser representativo das actividades noutras rexións xenómicas ou organismos. Para o mantemento das rexións de heterocromatina xa existentes, o RITS forma con siRNA un complexo complementario dos xenes locais e únese de forma estable ás histonas locais metiladas, actuando co-transcricionalmente para degradar calquera transcrito de pre-ARNm en formación que empece a formar a ARN polimerase. A formación desta rexión de heterocromatina, pero non o seu mantemento, é dependente de Dicer, probablemento porque se require Dicer para xerar o complemento inicial de siRNAs que se unirá aos transcritos que se formen posteriormente.[43] Suxeriuse que o mantemento da heterocromatina funciona como un bucle de retroalimentación autorreforzado, xa que os novos siRNA se forman pola RdRP (ARN polimerase dependente de ARN) a partir de transcritos nacentes ocasionais para a súa incorporación en complexos RITS locais.[44] A relevancia das observacións nas "rexións tipo apareamento" en lévedos e en centrómeros de mamíferos non está clara, xa que o mantemento da cromatina en células de mamíferos pode ser independente dos compoñentes da vía da interferencia de ARN (RNAi).[45]
Influencias entre a RNAi e a modificación do ARN
[editar | editar a fonte]O tipo de modificación ou "edición" do ARN máis frecuente en eucariotas superiores converte os nucleótidos de adenosina dos ARN de dobre cadea en nucleótidos de inosina por acción do encima adenosina desaminase (ADAR).[46] En 2000 propúxose inicialmente que as vías da interferencia de ARN (RNAi) e da "edición" A→I do ARN poderían competir por un mesmo substrato de ARN de dobre cadea.[47] De feito, algúns pre-microARN sofren a modificación A→I,[48][49] e este mecanismo pode regular o procesamento e a expresión dos microARN maduros.[49] Ademais, polo menos unha adenosina desaminase de mamífero pode secuestrar siRNA a partir dos compoñentes da vía de interferencia de ARN.[50] Outros apoios a este modelo veñen de estudos de estirpes de C. elegans sen adenosina desaminase que indican que a modificación A→I do ARN pode contrarrestar o silenciamento por interferencia de ARN de xenes endóxenos e transxenes.[51]
Variación entre organismos
[editar | editar a fonte]Os organismos vivos varían na súa capacidade de tomar ARN de dobre cadea e utilizalo na vía da interferencia de ARN. Os efectos da interferencia de ARN en plantas e C. elegans poden ser tanto sistémicos coma herdables, aínda que non en Drosophila ou nos mamíferos. Nas plantas, pénsase que a interferencia de ARN se propaga pola transferencia de siRNA entre células a través dos plasmodesmos (canles das paredes celulares que comunican dúas células).[24] A heredabilidade procede da metilación do ADN dos promotores que son dianas dos ARN interferentes; o novo patrón de metilación é copiado en cada nova xeración de células.[53] Unha distinción xeral entre plantas e animais está no modo de unión ao obxectivo dos microARN producidos endoxenamente; nas plantas os microARN son xeralmente perfectamente ou case perfectamente complementarios dos seus xenes diana e inducen o corte directo de ARNm polo RISC, mentres que os microARN de mamíferos tenden a ser máis diverxentes en secuencia e inducen a represión da tradución.[52] Este efecto sobre a tradución pode ser producido ao inhibir as interaccións dos factores iniciadores da tradución coa cola de poliadenina do ARNm.[54]
Algúns protozoos, como Leishmania major e Trypanosoma cruzi, carecen por completo da vía da interferencia de ARN (RNAi).[55][56] A maioría ou todos os compoñentes da RNAi tampouco se atopan nalgúns fungos, singularmente no lévedo Saccharomyces cerevisiae.[57] Porén, un estudo recente revela a presenza de interferencia de ARN noutras especies de lévedos de xemación, como Saccharomyces castellii e Candida albicans, demostrando ademais que inducir dúas proteínas relacionadas coa interferencia de ARN de S. castellii facilita a interferencia de ARN en S. cerevisiae.[58] O feito de que certos fungos ascomicetos e basidiomicetos estean perdendo as vías da interferencia de ARN indica que as proteínas requiridas para o silenciamento de ARN se perderon independentemente en moitas liñas evolutivas fúnxicas, posiblemente debido á evolución dunha nova vía con función similar, ou á ausencia de vantaxe selectiva en certos nichos ecolóxicos.[59]
Sistemas procarióticos relacionados
[editar | editar a fonte]A expresión xénica en procariotas está influenciada por un sistema baseado no ARN similar nalgúns aspectos á RNAi. Nestes seres vivos, xenes que codifican ARN controlan a abundancia de ARNm ou a tradución producindo un ARN complementario que se une por apareamento de bases complementarias co ARNm. Porén, estes ARN regulatorios xeralmente non se consideran análogos aos microARN porque non está implicado no proceso o encima Dicer.[60] Suxeriuse que os sistemas procarióticos de interferencia CRISPR (loci chamados Clustered Regularly Interspaced Short Palindromic Repeats) son análogos aos sistemas eucarióticos de interferencia de ARN, aínda que ningún dos compoñentes proteicos é ortólogo.[61]
Funcións biolóxicas
[editar | editar a fonte]Immunidade
[editar | editar a fonte]A interferencia de ARN é unha parte vital da resposta inmune a virus e outros materiais xenéticos alleos, especialmente en plantas, nas que pode tamén previr a auto-propagación de transposóns.[62] As plantas como Arabidopsis thaliana expresan múltiples homólogos de Dicer que se especializan en reaccionar de modo diferente cando a planta se expón a diferentes tipos de virus.[63] Xa antes de que a vía da interferencia de ARN (RNAi) fose completamente comprendida, sabíase que o silenciamento de xenes inducido en plantas podía estenderse a través de toda a planta cun efecto sistémico, e podía ser transferido por medio de enxertos.[64] Desde entón este fenómeno foi recoñecido como unha característica do sistema inmune adaptativo das plantas, e permite a toda a planta responder a un virus despois de ter un encontro inicial con el localizado.[65] En resposta a isto, en moitos virus de plantas evolucionaron mecanismos elaborados que suprimen a resposta de RNAi da célula da planta.[66] Isto inclúe a evolución de proteínas virais que se unen a fragmentos curtos de ARN de dobre cadea con extremos de cadea simple que sobresaen, como os que teñen os ARN sometidos á acción de Dicer.[67] Algúns xenomas de plantas tamén expresan siRNA endóxenos en resposta á infección por diversos tipos de bacterias.[68] Estes efectos poden ser parte dunha resposta xeneralizada da planta a patóxenos, que diminúe a actividade de calquera proceso metabólico da célula hóspede que axude ao proceso de infección.[69]
Aínda que os animais xeralmente expresan poucas variantes do encima Dicer comparados coas plantas, a interferencia de ARN (RNAi) nalgúns animais tamén dá lugar a unha resposta antiviral. Tanto en Drosophila inmatura coma adulta, a interferencia de ARN é importante na inmunidade innata antiviral e é activa contra patóxenos como o virus X de Drosophila.[70][71] Un papel similar na inmunidade pode funcionar en C. elegans, xa que a cantidade de proteínas argonauta se incrementa en resposta a virus, e os vermes que aumentan a expresión de compoñentes da vía da RNAi son resistentes á infección viral.[72][73]
A función da interferencia de ARN na inmunidade innata en mamíferos está mal comprendida, e hai relativamente poucos datos dispoñibles. Non obstante, a existencia de virus que codifican xenes capaces de suprimir a resposta de RNAi das células de mamíferos pode ser unha evidencia en favor da existencia dunha resposta inmune dependente da RNAi en mamíferos.[74][75] Porén, esta hipótese da inmunidade mediada pola interferencia de ARN en mamíferos é discutida e non está ben demostrada.[76] Tamén existen funcións alternativas á interferencia de ARN en virus de mamíferos, como os microARN expresados polos virus herpes que poden actuar como causantes da organización da heterocromatina para mediar a latencia viral.[77]
Diminución da expresión dun xene
[editar | editar a fonte]Os microARN expresados endoxenamente, incluíndo tanto microARN intrónicos coma interxénicos, son moi importantes na represión da tradución[52] e na regulación do desenvolvemento do organismo, especialmente na temporización da morfoxénese e no mantemento de tipos celulares indiferenciados ou diferenciados incompletamente como as células troncais ou nais.[78] A función dos microARN expresados endoxenamente na diminución da expresión xénica describiuse por primeira vez en C. elegans en 1993.[79] En plantas esta función descubriuse cando se demostrou que o "microARN JAW" de Arabidopsis estaba implicado na regulación de varios xenes que controlan a forma das plantas.[80] Nas plantas, a maioría dos xenes regulados por microARN son de factores de transcrición;[81] deste modo, a actividade dos microARN ten un alcance particularmente amplo e regula redes xénicas completas durante o desenvolvemento por medio da modulación da expresión de xenes regulatorios chave, incluíndo factores de transcrición como as proteínas F-box.[82] En moitos organismos, entre eles os humanos, os microARN foron tamén vinculados coa formación de tumores e a desregulación do ciclo celular. Neste caso, os micro ARN poden funcionar como oncoxenes ou como supresores de tumores.[83]
Amplificación da expresión dun xene
[editar | editar a fonte]As secuencias de ARN (siRNA e microARN) que son complementarias de partes dun promotor poden incrementar a transcrición dun xene, un fenómeno denominado activación de ARN ou RNAa. Coñécese parte do mecanismo polo que estes ARN amplifican a expresión dun xene: están implicados Dicer e Argonauta, posiblemente por medio da desmetilación de histonas.[84][85]. Tamén se propuxo que os microARN amplifican a expresión dos seus xenes diana parando o ciclo celular, pero os mecanismos polos que o realizan non están claros[86].
Evolución
[editar | editar a fonte]Baseándose en análises filoxenéticas de máxima parsimonia, o antepasado común máis recente de todos os eucariotas moi probablemente posuía xa un sistema primitivo de interferencia de ARN; a ausencia desta vía en certos eucariotas pénsase que se debe unha característica secundaria derivada.[87] Este sistema ancestral de RNAi contiña seguramente polo menos unha proteína similar a Dicer, unha Argonauta, unha proteína PIWI, e unha ARN polimerase dependente de ARN, que tamén podían desempeñar outras funcións na célula. Un estudo de xenómica comparada de ampla escala indica igualmente que o grupo coroa eucariótico xa posuía estes compoñentes, os cales puideron entón ter asociacións funcionais máis estreitas con sistemas de degradación xeneralizada de ARN como o complexo exosoma.[88] Este estudo tamén suxire que a familia de proteínas argonauta de unión ao ARN, que comparten os eucariotas, a maioría das arqueas, e polo menos algunhas bacterias (como Aquifex aeolicus), é homólogo e evolucionou orixinalmente a partir de compoñentes do sistema de tradución.
En xeral hai acordo en que a función ancestral do sistema de RNAi era a defensa inmune contra elementos xenéticos exóxenos como transposóns e xenomas virais.[87][89] Outras funcións relacionadas como as modificacións de histonas puideron estar xa presentes no antepasado dos eucariotas modernos, aínda que outras funcións como a regulación do desenvolvemento embrionario por microARN se cre que evolucionaron máis tarde.[87]
Os xenes da interferencia de ARN, como compoñentes do sistema inmunitario innato antiviral en moitos eucariotas, están implicados na carreira armamentística evolutiva cos xenes virais. Nalgúns virus evolucionaron mecanismos para suprimir a resposta da RNAi nas células hóspedes, un efecto que foi detectado especialmente nos virus de plantas.[66] Demostrouse en estudos das taxas evolutivas en Drosophila que os xenes na vía da RNAi están suxeitos a unha forte selección direccional e están entre os xenes de evolución máis rápida no xenoma de Drosophila.[90]
Aplicacións tecnolóxicas
[editar | editar a fonte]Knockdown de xenes
[editar | editar a fonte]A vía da interferencia de ARN é a miúdo aproveitada en bioloxía experimental para estudar a función dos xenes en cultivos celulares e in vivo en organismos modelo.[1] Nestes experimentos sintetízase ARN de dobre cadea cunha secuencia complementaria dun xene de interese e introdúcese nunha célula ou organismo, onde é recoñecido como material xenético exóxeno e activa a vía da interferencia (RNAi). Usando este mecanismo, os investigadores poden causar unha diminución drástica da expresión dun xene diana. Estudando os efectos desta diminución poden coñecerse as funcións fisiolóxicas do produto do xene. Como a RNAi non pode suprimir completamente a expresión do xene, esta técnica denomínase "knockdown", para distinguila dos procedementos "knockout" nos que a expresión do xene é completamente eliminada.[91]
Dedicáronse grandes esforzos en bioloxía computacional dirixidos a deseñar reactivos de ARN de dobre cadea que maximicen o knockdown pero minimicen os efectos "fóra de obxectivo" destas técnicas. Os efectos fóra do obxectivo orixínanse cando un ARN introducido ten unha secuencia de bases que pode aparearse complementariamente con múltiples xenes á vez e así reducir a expresión de todos eles. Estes problemas ocorren máis frecuentemente cando o ARN de dobre cadea (dsRNA) contén secuencias repetitivas. Estímase por estudos nos xenomas do H. sapiens, C. elegans, e S. pombe que arredor do 10% dos posibles siRNA van ter efectos fóra do obxectivo substanciais.[10] Desenvolveuse unha gran cantidade de ferramentas de software para aplicar algoritmos para o deseño de siRNA xeral,[92][93] específico de mamíferos,[94] e específico de virus[95], que son comprobados automaticamente para determinar a súa posible reactividade cruzada.
Dependo do organismo e o sistema experimental, o ARN exóxeno pode ser unha cadea longa deseñada para ser cortada por Dicer, ou un ARN curto deseñado para servir como substrato para os siRNA. Na maioría das células de mamíferos, úsanse ARN máis curtos porque as moléculas de ARN de dobre cadea longas inducen a resposta de interferón en mamíferos, un tipo de inmunidade innata que reacciona non especificamente co material xenético alleo.[96] Nos ovocitos de rato e nas células das fases embrionarias iniciais do rato está ausente esta reacción ao ARN de dobre cadea (dsRNA) exóxeno e son, por tanto, un sistema modelo común para estudar os efectos do knockdown de xenes en mamíferos.[97] Tamén se puxeron a punto técnicas especializadas de laboratorio para mellorar a utilidade da RNAi en sistemas de mamíferos evitando a introdución directa de siRNA; por exemplo, por medio da transfección estable con plásmidos que codifican a secuencia apropiada a partir da cal se pode transcribir un siRNA,[98] ou por sistemas vector de lentivirus máis elaborados, que permiten a activación inducible ou a desactivación da transcrición, coñecidas como interferencia de ARN condicional.[99][100]
Xenómica funcional
[editar | editar a fonte]

A maioría das aplicacións da xenómica funcional da RNAi en animais utilizaron a C. elegans[102] e Drosophila,[103] xa que estes son os organismos modelo nos que a interferencia de ARN (RNAi) é máis efectiva. C. elegans é especialmente útil para a investigación da RNAi por dúas razóns: a primeira é que os efectos do silenciamento de xenes son xeralmente herdables, e a segunda é que a introdución do ARN bicatenario (dsRNA) é extremadamente simple. Por medio dun mecanismo cuxos detalles non se coñecen ben, as bacterias como Escherichia coli que levan o dsRNA desexado poden servir de alimento aos vermes e así transferirlles o seu cargamento de ARN por vía intestinal. Esta "introdución durante a alimentación" é tan efectiva para inducir o silenciamento de xenes coma outros métodos máis custosos e que levan moito máis tempo, como meter os vermes nunha solución de dsRNA ou inxectar dsRNA nas gónadas.[104] Aínda que a introdución é máis difícil na maioría dos demais organismos, estanse a facer esforzos para realizar exames xenómicos a larga escala en cultivos celulares de células de mamíferos.[105]
O deseño de librarías de interferencia de ARN de todo o xenoma poden requirir máis sofisticación ca o deseño dun só siRNA para un conxunto determinado de condicións experimentais. Úsanse frecuentemente redes neurais artificiais para deseñar librarías de siRNA[106] e para predicir a súa probable eficiencia no knockdown de xenes.[107] Os exames xenómicos en masa considéranse un método moi prometedor para a anotación do xenoma (asociar información da súa estrutura e función aos xenes) e supuxeron o desenvolvemento de métodos de exame ou cribado de alto rendemento baseados en micromatrices ou microarrays.[108][109] Porén, a utilidade destes exames e a capacidade das técnicas desenvolvidas en organismos modelo para xeneralizalas a outras especies (mesmo relacionadas) foi cuestionado; por exemplo xeneralizar resultados de C. elegans a nematodos parasitos relacionados.[110][111]
A xenómica funcional que utiliza a interferencia de ARN é unha técnica particularmente atractiva para o mapeado xenómico e a anotación do xenoma en plantas porque moitas plantas son poliploides, o cal supón grandes retos para os métodos de enxeñaría xenética máis tradicionais. Por exemplo, a RNAi foi usada con éxito en estudos de xenómica funcional en trigo de panificación (que é hexaploide)[112] e tamén en modelos de planta máis comúns como Arabidopsis e millo.[113]
Medicina
[editar | editar a fonte]Tamén se utiliza a RNAi en terapéutica. Aínda que é difícil introducir ARN bicatenarios longos en células de mamíferos debido á resposta de interferón, o uso de moléculas que imitan aos siRNA foi moi exitosa.[114] Entre as primeiras aplicacións para probas clínicas están o tratamento da dexeneración macular e das infeccións polo virus respiratorio sincicial,[115] pero a RNAi tamén mostrou a súa efectividade en reverter os fallos hepáticos inducidos en modelos de rato.[116]
Outros usos médicos propostos céntranse nas terapias antivirais, como tratamentos microbicidas tópicos (realizados na Harvard University Medical School; en ratos polo momento), que usan a RNAi para tratar a infección polo virus herpes simplex tipo 2 e a inhibición da expresión xénica viral de células cancerosas,[117] o knockdown de receptores e correceptores do hóspede para o VIH,[118] silenciamento dos virus da hepatite A[119] e da hepatite B,[120] silenciamento da expresión xénica da influenza,[121] e a inhibición da replicación viral en casos de sarampelo.[122] Tamén se propuxeron tratamentos potenciais para enfermidades neurodexenerativas, con atención particular ás enfermidades de poliglutaminas como a enfermidade de Huntington.[123] A interferencia de ARN tamén se comtempla como un método prometedor para o tratamento do cáncer por medio do silenciamento de xenes que están sobreactivados diferencialmente nas células tumorais ou xenes implicados na división celular.[124][125] Unha área chave de investigación no uso da RNAi para aplicacións médicas é o desenvolvemento de métodos seguros de introdución dos ARN, o cal ata agora implica fundamentalmente a sistemas con vector viral similares aos propostos para a terapia xénica.[126][127]
Malia a proliferación de estudos prometedores en cultivos celulares de fármacos baseados na interferencia de ARN, hai algunha preocupación sobre a seguridade de dita interferencia, especialmente polos efectos potenciais "fóra do obxectivo" nos cales tamén se ve reprimido outro xene cunha secuencia casualmente similar á do xene diana.[128] Un estudo xenómico computacional estimou que a taxa de erro das interaccións fóra do obxectivo é de arredor do 10%.[10] Un importante estudo da enfermidade hepática nos ratos produciu unha alta proporción de mortes nos animais experimentais, o que se suxeriu que pode ser o resultado da "sobresaturación" da vía dos ARN bicatenarios (dsRNA),[129] debido ao uso de shRNA (small hairpin RNA) que teñen que ser procesados no núcleo e esportados ao citoplasma utilizando un mecanismo activo. Todas estas son consideracións que se están a investigar activamente, para reducir o seu impacto nas aplicacións terapéuticas potenciais da RNAi.
Estanse preparando tamén aplicacións baseadas na interferencia de ARN que teñen como obxectivo as infeccións persistentes por VIH-1. Os virus como o VIH-1 son dianas particularmente difíciles para o ataque por interferencia de ARN porque son propensos a escapar del, polo que se requiren estratexias de RNAi combinatoria para previr o escape viral. O futuro das terapéuticas por RNAi antiviral é moi prometedor, pero segue tendo a máxima importancia incluír moitos controis nos modelos das probas pre-clínicas para demostrar de forma inequívoca a acción específica da secuencia dos indutores da RNAi.[130]
Biotecnoloxía
[editar | editar a fonte]A interferencia de ARN utilízase en diversas aplicacións biotecnolóxicas, especialmente na enxeñaría xenética de plantas comestibles que produce baixos niveis de toxinas vexetais naturais. Tales técnicas toman vantaxe do fenotipo RNAi estable e herdable en poboacións de plantas. Por exemplo, as sementes de algodón son ricas en proteínas nutritivas pero conteñen de forma natural un produto terpenoide tóxico chamado gosipol, o que as fai inadecuadas para o consumo humano. A interferencia de ARN foi usada para producir poboacións de algodón con sementes de baixo contido en delta-cadineno sintase, un encima chave para a produción do gosipol, sen que isto afecte á produción do encima noutras partes da planta, onde o gosipol é importante para impedir os danos causados por pragas.[131] Esforzos similares dirixíronse cara á redución dun produto cianoxénico natural chamado linamarina nas plantas de mandioca.[132]
Aínda que polo momento ningún produto vexetal orixinado por enxeñaría xenética baseada na interferencia de ARN pasou da fase puramente experimental, os esforzos realizados no seu desenvolvemento xa reduciron con éxito os niveis de alérxenos no tomate[133] e fixeron descender os niveis dos precursores de probables carcinóxenos na planta do tabaco.[134] Outras características de plantas que foron modificadas por enxeñaría xenética son a produción de produtos naturais sen efectos narcóticos na papoula do opio,[135] a resistencia a diversos virus comúns das plantas,[136] e a fortificación de plantas como os tomates con antioxidantes dietarios.[137] Produtos comercializados inicialmente, como o tomate Flavr Savr e dous cultivares de papaia resistentes ao virus das manchas circulares da papaia, foron orixinalmente desenvolvidas utilizando a tecnoloxía antisentido pero aproveitando probablemente a vía da RNAi.[138][139]
Rastreo de RNAi a escala xenómica
[editar | editar a fonte]A investigación da RNAi a escala xenómica depende da tecnoloxía do cribado ou rastreo de alto rendemento (HTS, High-throughput Screening). A tecnoloxía HTS de interferencia de ARN permite un exame de perdas de función de xenes en todo o xenoma e úsase moito na identificación de xenes asociados con fenotipos biolóxicos específicos. Esta tecnoloxía foi celebrada como a segunda onda da xenómica, despois da que foi a primeira, o microarray para a expresión xénica e o polimorfismo dun único nucleótido [140]. Unha das maiores vantaxes do exame (ou cribado) de RNAi a escala xenómica é a súa capacidade para examinar simultaneamente miles de xenes. Coa súa capacidade de xerar unha gran cantidade de datos en cada experimento, o exame de RNAi a escala xenómica levou a unha explosión na cantidade de datos xerada. En consecuencia, un dos retos principais nas investigacións de RNAi a escala xenómica é extraer significancia biolóxica da análise dunha morea de datos, o cal require a adopción de métodos estatísticos/bioinformáticos axeitados como os presentados nun libro de recente publicación [141] sobre o cribado de RNAi. O proceso básico dos exames de RNAi baseados en células comprende: (1º) a elección dunha libraría de RNAi, (2º) a selección dun tipo de células estable e resistente, (3º) a transfección de células seleccionadas con axentes de RNAi da libraría de RNAi elixida, (4º) a incubación ou tratamento necesario, (5º) a detección de sinais, (6º) a análise estatística e bioinformática, e (7º) a determinación de xenes importantes ou dianas terapéuticas [141].
Historia e descubrimento
[editar | editar a fonte]
O descubrimento da interferencia de ARN foi precedido por observacións de inhibición transcricional por ARN antisentido expresado en plantas transxénicas,[143] e máis directamente por informes de resultados inesperados en investigacións realizadas por científicos que experimentaban con plantas en Estados Unidos e Países Baixos a inicios da década de 1990.[144] Para intentar alterar as cores das flores das petunias, os investigadores introduciron copias adicionais dunha chalcona sintase xeneticamente codificada, un encima chave para a pigmentación da flor nas petunias dunha cor normalmente rosa ou violeta. Esperábase que o xene sobreexpresado orixinase flores máis escuras, pero o que obtiveron foron flores menos pigmentadas, parcial ou totalmente brancas, o que indicaba que a actividade da chalcona sintase fora substancialmente diminuída; de feito, nas flores brancas estaba reducida a expresión tanto dos xenes endóxenos coma dos transxenes introducidos. Pouco despois, foi detectado no fungo Neurospora crassa un efecto relacionado chamado "sufocamento" (quelling),[145] aínda que naquel momento esta relación non foi inmediatamente recoñecida. Posteriores investigacións do fenómeno en plantas indicaron que a regulación á baixa da expresión do xene era debida a inhibición postranscricional da expresión xenética por medio do incremento das taxas de degradación do ARNm.[146] Este fenómeno foi denominado co-supresión da expresión xénica, pero os mecanismos moleculares seguían sen coñecerse.[147]
Non moito despois, os virologos de plantas traballando na mellora da resistencia das plantas ás doenzas virais observaron un fenómeno inesperado similar. Aínda que se sabía que as plantas que expresaban proteínas específicas de virus mostraban un incremento da tolerancia ou resistencia á infección viral, non se agardaba que as plantas que levasen só rexións non codificantes curtas de secuencias de ARN viral mostrasen niveis similares de protección. Os investigadores crían que o ARN viral producido por transxenes podía tamén inhibir a replicación viral.[148] O experimento inverso, no cal eran introducidos dentro dos virus secuencias curtas de xenes de plantas, mostraban que o xene diana era suprimido nas plantas infectadas por eses virus. Este fenómeno foi denominado "silenciamento de xenes inducido por virus" (VIGS), e o conxunto de todos estes fenómenos foi chamado silenciamento de xenes postranscricional.[149]
Despois destas observacións iniciais en plantas, moitos laboratorios de todo o mundo investigaron a presenza destes fenómenos noutros organismos.[150][151] En 1998 Craig C. Mello e Andrew Fire publicaron en Nature un traballo no que se informaba dun potente efecto de silenciamento de xenes despois da inxección de ARN de dobre cadea en C. elegans.[2] Ao investigaren a regulación da produción de proteína muscular, observaron que nin as inxeccións de ARNm nin de ARN antisentido tiñan efecto na produción de proteínas, pero que o ARN de dobre cadea (dsRNA) silenciaba o xene diana con éxito. Como resultado deste traballo, estes investigadores acuñaron o termo RNAi (interferencia de ARN). Os descubrimentos de Fire e Mello foron particularmente notables porque representaban a primeira identificación do axente causante do fenómeno. Fire e Mello recibiron o Premio Nobel de Medicina e Fisioloxía en 2006 por estes traballos.[1]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 1,3 1,4 Daneholt, Bertil. "Advanced Information: RNA interference". The Nobel Prize in Physiology or Medicine 2006. Consultado o 2007-01-25.
- ↑ 2,0 2,1 Fire A, Xu S, Montgomery M, Kostas S, Driver S, Mello C (1998). "Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans". Nature 391 (6669): 806–11. Bibcode:1998Natur.391..806F. PMID 9486653. doi:10.1038/35888.
- ↑ Macrae I, Zhou K, Li F, Repic A, Brooks A, Cande W, Adams P, Doudna J (2006). "Structural basis for double-stranded RNA processing by dicer". Science 311 (5758): 195–8. PMID 16410517. doi:10.1126/science.1121638.
- ↑ Bagasra O, Prilliman KR (2004). "RNA interference: the molecular immune system". J. Mol. Histol. 35 (6): 545–53. PMID 15614608. doi:10.1007/s10735-004-2192-8. Arquivado dende o orixinal (PDF) o 14 de marzo de 2020. Consultado o 03 de setembro de 2011.
- ↑ Bernstein E, Caudy A, Hammond S, Hannon G (2001). "Role for a bidentate ribonuclease in the initiation step of RNA interference". Nature 409 (6818): 363–6. PMID 11201747. doi:10.1038/35053110.
- ↑ Siomi, Haruhiko; Siomi, Mikiko C. (22 de xaneiro de 2009). "On the road to reading the RNA-interference code". Nature 457 (7228): 396–404. PMID 19158785. doi:10.1038/nature07754.
- ↑ Zamore P, Tuschl T, Sharp P, Bartel D (2000). "RNAi: double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals". Cell 101 (1): 25–33. PMID 10778853. doi:10.1016/S0092-8674(00)80620-0.
- ↑ Vermeulen A, Behlen L, Reynolds A, Wolfson A, Marshall W, Karpilow J, Khvorova A (2005). "The contributions of dsRNA structure to dicer specificity and efficiency". RNA 11 (5): 674–82. PMC 1370754. PMID 15811921. doi:10.1261/rna.7272305.
- ↑ Castanotto, Daniela; Rossi, John J. (22 de xaneiro de 2009). "The promises and pitfalls of RNA-interference-based therapeutics". Nature 457 (7228): 426–433. PMC 2702667. PMID 19158789. doi:10.1038/nature07758.
- ↑ 10,0 10,1 10,2 Qiu S, Adema C, Lane T (2005). "A computational study of off-target effects of RNA interference". Nucleic Acids Res 33 (6): 1834–47. PMC 1072799. PMID 15800213. doi:10.1093/nar/gki324.
- ↑ Ahlquist P (2002). "RNA-dependent RNA polymerases, viruses, and RNA silencing". Science 296 (5571): 1270–3. PMID 12016304. doi:10.1126/science.1069132.
- ↑ 12,0 12,1 Parker G, Eckert D, Bass B (2006). "RDE-4 preferentially binds long dsRNA and its dimerization is necessary for cleavage of dsRNA to siRNA". RNA 12 (5): 807–18. PMC 1440910. PMID 16603715. doi:10.1261/rna.2338706.
- ↑ Liu Q, Rand T, Kalidas S, Du F, Kim H, Smith D, Wang X (2003). "R2D2, a bridge between the initiation and effector steps of the Drosophila RNAi pathway". Science 301 (5641): 1921–5. PMID 14512631. doi:10.1126/science.1088710.
- ↑ Baulcombe D (2007). "Molecular biology. Amplified silencing". Science 315 (5809): 199–200. PMID 17218517. doi:10.1126/science.1138030.
- ↑ Pak J, Fire A (2007). "Distinct populations of primary and secondary effectors during RNAi in C. elegans". Science 315 (5809): 241–4. PMID 17124291. doi:10.1126/science.1132839.
- ↑ Sijen T, Steiner F, Thijssen K, Plasterk R (2007). "Secondary siRNAs result from unprimed RNA synthesis and form a distinct class". Science 315 (5809): 244–7. PMID 17158288. doi:10.1126/science.1136699.
- ↑ Wang QL, Li ZH (2007). "The functions of microRNAs in plants". Front. Biosci. 12: 3975–82. PMID 17485351.
- ↑ Zhao Y, Srivastava D (2007). "A developmental view of microRNA function". Trends Biochem. Sci. 32 (4): 189–97. PMID 17350266. doi:10.1016/j.tibs.2007.02.006.
- ↑ Gregory R, Chendrimada T, Shiekhattar R (2006). "MicroRNA biogenesis: isolation and characterization of the microprocessor complex". Methods Mol Biol 342: 33–47. PMID 16957365. doi:10.1385/1-59745-123-1:33.
- ↑ Pillai RS, Bhattacharyya SN, Filipowicz W (2007). "Repression of protein synthesis by miRNAs: how many mechanisms?". Trends Cell Biol 17 (3): 118–26. PMID 17197185. doi:10.1016/j.tcb.2006.12.007.
- ↑ Okamura K, Ishizuka A, Siomi H, Siomi M (2004). "Distinct roles for Argonaute proteins in small RNA-directed RNA cleavage pathways". Genes Dev 18 (14): 1655–66. PMC 478188. PMID 15231716. doi:10.1101/gad.1210204.
- ↑ Lee Y, Nakahara K, Pham J, Kim K, He Z, Sontheimer E, Carthew R (2004). "Distinct roles for Drosophila Dicer-1 and Dicer-2 in the siRNA/miRNA silencing pathways". Cell 117 (1): 69–81. PMID 15066283. doi:10.1016/S0092-8674(04)00261-2.
- ↑ Gregory R, Chendrimada T, Cooch N, Shiekhattar R (2005). "Human RISC couples microRNA biogenesis and posttranscriptional gene silencing". Cell 123 (4): 631–40. PMID 16271387. doi:10.1016/j.cell.2005.10.022.
- ↑ 24,0 24,1 Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipurksy SL, Darnell J (2004). WH Freeman: New York, NY, ed. Molecular Cell Biology (5th ed.). ISBN 978-0716743668.[1]
- ↑ Matranga C, Tomari Y, Shin C, Bartel D, Zamore P (2005). "Passenger-strand cleavage facilitates assembly of siRNA into Ago2-containing RNAi enzyme complexes". Cell 123 (4): 607–20. PMID 16271386. doi:10.1016/j.cell.2005.08.044.
- ↑ Leuschner P, Ameres S, Kueng S, Martinez J (2006). "Cleavage of the siRNA passenger strand during RISC assembly in human cells". EMBO Rep 7 (3): 314–20. PMC 1456892. PMID 16439995. doi:10.1038/sj.embor.7400637.
- ↑ Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N, Zamore PD (2003). "Asymmetry in the assembly of the RNAi enzyme complex". Cell 115 (2): 199–208. PMID 14567917. doi:10.1016/S0092-8674(03)00759-1.
- ↑ Preall J, He Z, Gorra J, Sontheimer E (2006). "Short interfering RNA strand selection is independent of dsRNA processing polarity during RNAi in Drosophila". Curr Biol 16 (5): 530–5. PMID 16527750. doi:10.1016/j.cub.2006.01.061.
- ↑ Tomari Y, Matranga C, Haley B, Martinez N, Zamore P (2004). "A protein sensor for siRNA asymmetry". Science 306 (5700): 1377–80. PMID 15550672. doi:10.1126/science.1102755.
- ↑ Ma J, Yuan Y, Meister G, Pei Y, Tuschl T, Patel D (2005). "Structural basis for 5'-end-specific recognition of guide RNA by the A. fulgidus Piwi protein". Nature 434 (7033): 666–70. PMID 15800629. doi:10.1038/nature03514.
- ↑ Sen G, Wehrman T, Blau H (2005). "mRNA translation is not a prerequisite for small interfering RNA-mediated mRNA cleavage". Differentiation 73 (6): 287–93. PMID 16138829. doi:10.1111/j.1432-0436.2005.00029.x.
- ↑ Gu S, Rossi J (2005). "Uncoupling of RNAi from active translation in mammalian cells". RNA 11 (1): 38–44. PMC 1370689. PMID 15574516. doi:10.1261/rna.7158605.
- ↑ Sen G, Blau H (2005). "Argonaute 2/RISC resides in sites of mammalian mRNA decay known as cytoplasmic bodies". Nat Cell Biol 7 (6): 633–6. PMID 15908945. doi:10.1038/ncb1265.
- ↑ Lian S, Jakymiw A, Eystathioy T, Hamel J, Fritzler M, Chan E (2006). "GW bodies, microRNAs and the cell cycle". Cell Cycle 5 (3): 242–5. PMID 16418578. doi:10.4161/cc.5.3.2410.
- ↑ Jakymiw A, Lian S, Eystathioy T, Li S, Satoh M, Hamel J, Fritzler M, Chan E (2005). "Disruption of P bodies impairs mammalian RNA interference". Nat Cell Biol 7 (12): 1267–74. PMID 16284622. doi:10.1038/ncb1334.
- ↑ Hammond S, Bernstein E, Beach D, Hannon G (2000). "An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells". Nature 404 (6775): 293–6. PMID 10749213. doi:10.1038/35005107.
- ↑ Holmquist G, Ashley T (2006). "Chromosome organization and chromatin modification: influence on genome function and evolution". Cytogenet Genome Res 114 (2): 96–125. PMID 16825762. doi:10.1159/000093326.
- ↑ Verdel A, Jia S, Gerber S, Sugiyama T, Gygi S, Grewal S, Moazed D (2004). "RNAi-mediated targeting of heterochromatin by the RITS complex". Science 303 (5658): 672–6. PMID 14704433. doi:10.1126/science.1093686.
- ↑ Irvine D, Zaratiegui M, Tolia N, Goto D, Chitwood D, Vaughn M, Joshua-Tor L, Martienssen R (2006). "Argonaute slicing is required for heterochromatic silencing and spreading". Science 313 (5790): 1134–7. PMID 16931764. doi:10.1126/science.1128813.
- ↑ Volpe T, Kidner C, Hall I, Teng G, Grewal S, Martienssen R (2002). "Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi". Science 297 (5588): 1833–7. PMID 12193640. doi:10.1126/science.1074973.
- ↑ Volpe T, Schramke V, Hamilton G, White S, Teng G, Martienssen R, Allshire R (2003). "RNA interference is required for normal centromere function in fission yeast". Chromosome Res 11 (2): 137–46. PMID 12733640. doi:10.1023/A:1022815931524.
- ↑ Li LC, Okino ST, Zhao H, Pookot D, Place RF, Urakami S, Enokida H, Dahiya R (2006). "Small dsRNAs induce transcriptional activation in human cells". Proc Natl Acad Sci USA 103 (46): 17337–42. PMC 1859931. PMID 17085592. doi:10.1073/pnas.0607015103.
- ↑ Noma K, Sugiyama T, Cam H, Verdel A, Zofall M, Jia S, Moazed D, Grewal S (2004). "RITS acts in cis to promote RNA interference-mediated transcriptional and post-transcriptional silencing". Nat Genet 36 (11): 1174–80. PMID 15475954. doi:10.1038/ng1452.
- ↑ Sugiyama T, Cam H, Verdel A, Moazed D, Grewal S (2005). "RNA-dependent RNA polymerase is an essential component of a self-enforcing loop coupling heterochromatin assembly to siRNA production". Proc Natl Acad Sci USA 102 (1): 152–7. PMC 544066. PMID 15615848. doi:10.1073/pnas.0407641102.
- ↑ Wang F, Koyama N, Nishida H, Haraguchi T, Reith W, Tsukamoto T (2006). "The assembly and maintenance of heterochromatin initiated by transgene repeats are independent of the RNA interference pathway in mammalian cells". Mol Cell Biol 26 (11): 4028–40. PMC 1489094. PMID 16705157. doi:10.1128/MCB.02189-05.
- ↑ Bass B (2002). "RNA editing by adenosine deaminases that act on RNA". Annu Rev Biochem 71: 817–46. PMC 1823043. PMID 12045112. doi:10.1146/annurev.biochem.71.110601.135501.
- ↑ Bass B (2000). "Double-stranded RNA as a template for gene silencing". Cell 101 (3): 235–8. PMID 10847677. doi:10.1016/S0092-8674(02)71133-1.
- ↑ Luciano D, Mirsky H, Vendetti N, Maas S (2004). "RNA editing of a miRNA precursor". RNA 10 (8): 1174–7. PMC 1370607. PMID 15272117. doi:10.1261/rna.7350304.
- ↑ 49,0 49,1 Yang W, Chendrimada T, Wang Q, Higuchi M, Seeburg P, Shiekhattar R, Nishikura K (2006). "Modulation of microRNA processing and expression through RNA editing by ADAR deaminases". Nat Struct Mol Biol 13 (1): 13–21. PMC 2950615. PMID 16369484. doi:10.1038/nsmb1041.
- ↑ Yang W, Wang Q, Howell K, Lee J, Cho D, Murray J, Nishikura K (2005). "ADAR1 RNA deaminase limits short interfering RNA efficacy in mammalian cells". J Biol Chem 280 (5): 3946–53. PMC 2947832. PMID 15556947. doi:10.1074/jbc.M407876200.
- ↑ Nishikura K (2006). "Editor meets silencer: crosstalk between RNA editing and RNA interference". Nat Rev Mol Cell Biol 7 (12): 919–31. PMC 2953463. PMID 17139332. doi:10.1038/nrm2061.
- ↑ 52,0 52,1 52,2 Saumet A, Lecellier CH (2006). "Anti-viral RNA silencing: do we look like plants?". Retrovirology 3 (3): 3. PMC 1363733. PMID 16409629. doi:10.1186/1742-4690-3-3.
- ↑ Jones L, Ratcliff F, Baulcombe DC (2001). "RNA-directed transcriptional gene silencing in plants can be inherited independently of the RNA trigger and requires Met1 for maintenance". Current Biology 11 (10): 747–757. PMID 11378384. doi:10.1016/S0960-9822(01)00226-3. Arquivado dende o orixinal o 21 de decembro de 2007. Consultado o 03 de setembro de 2011.
- ↑ Humphreys DT, Westman BJ, Martin DI, Preiss T (2005). "MicroRNAs control translation initiation by inhibiting eukaryotic initiation factor 4E/cap and poly(A) tail function.". Proc Natl Acad Sci USA 102 (47): 16961–16966. PMC 1287990. PMID 16287976. doi:10.1073/pnas.0506482102.
- ↑ DaRocha W, Otsu K, Teixeira S, Donelson J (2004). "Tests of cytoplasmic RNA interference (RNAi) and construction of a tetracycline-inducible T7 promoter system in Trypanosoma cruzi". Mol Biochem Parasitol 133 (2): 175–86. PMID 14698430. doi:10.1016/j.molbiopara.2003.10.005.
- ↑ Robinson K, Beverley S (2003). "Improvements in transfection efficiency and tests of RNA interference (RNAi) approaches in the protozoan parasite Leishmania". Mol Biochem Parasitol 128 (2): 217–28. PMID 12742588. doi:10.1016/S0166-6851(03)00079-3.
- ↑ L. Aravind, Hidemi Watanabe, David J. Lipman, and Eugene V. Koonin (2000). "Lineage-specific loss and divergence of functionally linked genes in eukaryotes". Proceedings of the National Academy of Sciences 97 (21): 11319–11324. PMC 17198. PMID 11016957. doi:10.1073/pnas.200346997.
- ↑ Drinnenberg IA, Weinberg DE, Xie KT, Nower JP, Wolfe KH, Fink GR, Bartel DP (2009). "RNAi in Budding Yeast". Science 326 (5952): 544–50. PMID 19745116. doi:10.1126/science.1176945.
- ↑ Nakayashiki H, Kadotani N, Mayama S (2006). "Evolution and diversification of RNA silencing proteins in fungi". J Mol Evol 63 (1): 127–35. PMID 16786437. doi:10.1007/s00239-005-0257-2.
- ↑ Morita T, Mochizuki Y, Aiba H (2006). "Translational repression is sufficient for gene silencing by bacterial small noncoding RNAs in the absence of mRNA destruction". Proc Natl Acad Sci USA 103 (13): 4858–63. PMC 1458760. PMID 16549791. doi:10.1073/pnas.0509638103.
- ↑ Makarova K, Grishin N, Shabalina S, Wolf Y, Koonin E (2006). "A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action". Biol Direct 1: 7. PMC 1462988. PMID 16545108. doi:10.1186/1745-6150-1-7.
- ↑ Stram Y, Kuzntzova L (2006). "Inhibition of viruses by RNA interference". Virus Genes 32 (3): 299–306. PMID 16732482. doi:10.1007/s11262-005-6914-0.
- ↑ Blevins T, Rajeswaran R, Shivaprasad P, Beknazariants D, Si-Ammour A, Park H, Vazquez F, Robertson D, Meins F, Hohn T, Pooggin M (2006). "Four plant Dicers mediate viral small RNA biogenesis and DNA virus induced silencing". Nucleic Acids Res 34 (21): 6233–46. PMC 1669714. PMID 17090584. doi:10.1093/nar/gkl886.
- ↑ Palauqui J, Elmayan T, Pollien J, Vaucheret H (1997). "Systemic acquired silencing: transgene-specific post-transcriptional silencing is transmitted by grafting from silenced stocks to non-silenced scions". EMBO J 16 (15): 4738–45. PMC 1170100. PMID 9303318. doi:10.1093/emboj/16.15.4738.
- ↑ Voinnet O (2001). "RNA silencing as a plant immune system against viruses". Trends Genet 17 (8): 449–59. PMID 11485817. doi:10.1016/S0168-9525(01)02367-8.
- ↑ 66,0 66,1 Lucy A, Guo H, Li W, Ding S (2000). "Suppression of post-transcriptional gene silencing by a plant viral protein localized in the nucleus". EMBO J 19 (7): 1672–80. PMC 310235. PMID 10747034. doi:10.1093/emboj/19.7.1672.
- ↑ Mérai Z, Kerényi Z, Kertész S, Magna M, Lakatos L, Silhavy D (2006). "Double-stranded RNA binding may be a general plant RNA viral strategy to suppress RNA silencing". J Virol 80 (12): 5747–56. PMC 1472586. PMID 16731914. doi:10.1128/JVI.01963-05.
- ↑ Katiyar-Agarwal S, Morgan R, Dahlbeck D, Borsani O, Villegas A, Zhu J, Staskawicz B, Jin H (2006). "A pathogen-inducible endogenous siRNA in plant immunity". Proc Natl Acad Sci USA 103 (47): 18002–7. PMC 1693862. PMID 17071740. doi:10.1073/pnas.0608258103.
- ↑ Fritz J, Girardin S, Philpott D (2006). "Innate immune defense through RNA interference". Sci STKE 2006 (339): pe27. PMID 16772641. doi:10.1126/stke.3392006pe27.
- ↑ Zambon R, Vakharia V, Wu L (2006). "RNAi is an antiviral immune response against a dsRNA virus in Drosophila melanogaster". Cell Microbiol 8 (5): 880–9. PMID 16611236. doi:10.1111/j.1462-5822.2006.00688.x.
- ↑ Wang X, Aliyari R, Li W, Li H, Kim K, Carthew R, Atkinson P, Ding S (2006). "RNA interference directs innate immunity against viruses in adult Drosophila". Science 312 (5772): 452–4. PMC 1509097. PMID 16556799. doi:10.1126/science.1125694.
- ↑ Lu R, Maduro M, Li F, Li H, Broitman-Maduro G, Li W, Ding S (2005). "Animal virus replication and RNAi-mediated antiviral silencing in Caenorhabditis elegans". Nature 436 (7053): 1040–3. PMC 1388260. PMID 16107851. doi:10.1038/nature03870.
- ↑ Wilkins C, Dishongh R, Moore S, Whitt M, Chow M, Machaca K (2005). "RNA interference is an antiviral defence mechanism in Caenorhabditis elegans". Nature 436 (7053): 1044–7. PMID 16107852. doi:10.1038/nature03957.
- ↑ Berkhout B, Haasnoot J (2006). "The interplay between virus infection and the cellular RNA interference machinery". FEBS Lett 580 (12): 2896–902. PMID 16563388. doi:10.1016/j.febslet.2006.02.070.
- ↑ Schütz S, Sarnow P (2006). "Interaction of viruses with the mammalian RNA interference pathway". Virology 344 (1): 151–7. PMID 16364746. doi:10.1016/j.virol.2005.09.034.
- ↑ Cullen B (2006). "Is RNA interference involved in intrinsic antiviral immunity in mammals?". Nat Immunol 7 (6): 563–7. PMID 16715068. doi:10.1038/ni1352.
- ↑ Carrington J, Ambros V (2003). "Role of microRNAs in plant and animal development". Science 301 (5631): 336–8. PMID 12869753. doi:10.1126/science.1085242.
- ↑ Lee R, Feinbaum R, Ambros V (1993). "The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14". Cell 75 (5): 843–54. PMID 8252621. doi:10.1016/0092-8674(93)90529-Y.
- ↑ Palatnik J, Allen E, Wu X, Schommer C, Schwab R, Carrington J, Weigel D (2003). "Control of leaf morphogenesis by microRNAs". Nature 425 (6955): 257–63. PMID 12931144. doi:10.1038/nature01958.
- ↑ Zhang B, Pan X, Cobb G, Anderson T (2006). "Plant microRNA: a small regulatory molecule with big impact". Dev Biol 289 (1): 3–16. PMID 16325172. doi:10.1016/j.ydbio.2005.10.036.
- ↑ Jones-Rhoades M, Bartel D, Bartel B (2006). "MicroRNAS and their regulatory roles in plants". Annu Rev Plant Biol 57: 19–53. PMID 16669754. doi:10.1146/annurev.arplant.57.032905.105218.
- ↑ Zhang B, Pan X, Cobb G, Anderson T (2007). "microRNAs as oncogenes and tumor suppressors". Dev Biol 302 (1): 1–12. PMID 16989803. doi:10.1016/j.ydbio.2006.08.028.
- ↑ Check E (2007). "RNA interference: hitting the on switch". Nature 448 (7156): 855–858. PMID 17713502. doi:10.1038/448855a.
- ↑ Li LC, Okino ST, Zhao H; et al. (2006). "Small dsRNAs induce transcriptional activation in human cells". Proc. Natl. Acad. Sci. U.S.A. 103 (46): 17337–42. PMC 1859931. PMID 17085592. doi:10.1073/pnas.0607015103.
- ↑ Vasudevan, S.; Tong, Y.; Steitz, J. A. (2007). "Switching from Repression to Activation: MicroRNAs Can Up-Regulate Translation". Science 318 (5858): 1931–1934. doi:10.1126/science.1149460. PMID 18048652.
- ↑ 87,0 87,1 87,2 Cerutti H, Casas-Mollano J (2006). "On the origin and functions of RNA-mediated silencing: from protists to man". Curr Genet 50 (2): 81–99. PMC 2583075. PMID 16691418. doi:10.1007/s00294-006-0078-x.
- ↑ Anantharaman V, Koonin E, Aravind L (2002). "Comparative genomics and evolution of proteins involved in RNA metabolism". Nucleic Acids Res 30 (7): 1427–64. PMC 101826. PMID 11917006. doi:10.1093/nar/30.7.1427.
- ↑ Buchon N, Vaury C (2006). "RNAi: a defensive RNA-silencing against viruses and transposable elements". Heredity 96 (2): 195–202. PMID 16369574. doi:10.1038/sj.hdy.6800789.
- ↑ Obbard D, Jiggins F, Halligan D, Little T (2006). "Natural selection drives extremely rapid evolution in antiviral RNAi genes". Curr Biol 16 (6): 580–5. PMID 16546082. doi:10.1016/j.cub.2006.01.065.
- ↑ Voorhoeve PM, Agami R (2003). "Knockdown stands up". Trends Biotechnol. 21 (1): 2–4. PMID 12480342. doi:10.1016/S0167-7799(02)00002-1.
- ↑ Naito Y, Yamada T, Matsumiya T, Ui-Tei K, Saigo K, Morishita S (2005). "dsCheck: highly sensitive off-target search software for double-stranded RNA-mediated RNA interference". Nucleic Acids Res 33 (Web Server issue): W589–91. PMC 1160180. PMID 15980542. doi:10.1093/nar/gki419.
- ↑ Henschel A, Buchholz F, Habermann B (2004). "DEQOR: a web-based tool for the design and quality control of siRNAs". Nucleic Acids Res 32 (Web Server issue): W113–20. PMC 441546. PMID 15215362. doi:10.1093/nar/gkh408.
- ↑ Naito Y, Yamada T, Ui-Tei K, Morishita S, Saigo K (2004). "siDirect: highly effective, target-specific siRNA design software for mammalian RNA interference". Nucleic Acids Res 32 (Web Server issue): W124–9. PMC 441580. PMID 15215364. doi:10.1093/nar/gkh442.
- ↑ Naito Y, Ui-Tei K, Nishikawa T, Takebe Y, Saigo K (2006). "siVirus: web-based antiviral siRNA design software for highly divergent viral sequences". Nucleic Acids Res 34 (Web Server issue): W448–50. PMC 1538817. PMID 16845046. doi:10.1093/nar/gkl214.
- ↑ Reynolds A, Anderson E, Vermeulen A, Fedorov Y, Robinson K, Leake D, Karpilow J, Marshall W, Khvorova A (2006). "Induction of the interferon response by siRNA is cell type- and duplex length-dependent". RNA 12 (6): 988–93. PMC 1464853. PMID 16611941. doi:10.1261/rna.2340906.
- ↑ Stein P, Zeng F, Pan H, Schultz R (2005). "Absence of non-specific effects of RNA interference triggered by long double-stranded RNA in mouse oocytes". Dev Biol 286 (2): 464–71. PMID 16154556. doi:10.1016/j.ydbio.2005.08.015.
- ↑ Brummelkamp T, Bernards R, Agami R (2002). "A system for stable expression of short interfering RNAs in mammalian cells". Science 296 (5567): 550–3. PMID 11910072. doi:10.1126/science.1068999.
- ↑ Tiscornia G, Tergaonkar V, Galimi F, Verma I (2004). "CRE recombinase-inducible RNA interference mediated by lentiviral vectors". Proc Natl Acad Sci USA 101 (19): 7347–51. PMC 409921. PMID 15123829. doi:10.1073/pnas.0402107101.
- ↑ Ventura A, Meissner A, Dillon C, McManus M, Sharp P, Van Parijs L, Jaenisch R, Jacks T (2004). "Cre-lox-regulated conditional RNA interference from transgenes". Proc Natl Acad Sci USA 101 (28): 10380–5. PMC 478580. PMID 15240889. doi:10.1073/pnas.0403954101.
- ↑ Brock T, Browse J, Watts J (2006). "Genetic regulation of unsaturated fatty acid composition in C. elegans". PLoS Genet 2 (7): e108. PMC 1500810. PMID 16839188. doi:10.1371/journal.pgen.0020108. Arquivado dende o orixinal o 22 de febreiro de 2008. Consultado o 25 de agosto de 2018.
- ↑ Kamath R, Ahringer J (2003). "Genome-wide RNAi screening in Caenorhabditis elegans". Methods 30 (4): 313–21. PMID 12828945. doi:10.1016/S1046-2023(03)00050-1.
- ↑ Boutros M, Kiger A, Armknecht S, Kerr K, Hild M, Koch B, Haas S, Paro R, Perrimon N (2004). "Genome-wide RNAi analysis of growth and viability in Drosophila cells". Science 303 (5659): 832–5. PMID 14764878. doi:10.1126/science.1091266.
- ↑ Fortunato A, Fraser A (2005). "Uncover genetic interactions in Caenorhabditis elegans by RNA interference". Biosci Rep 25 (5–6): 299–307. PMID 16307378. doi:10.1007/s10540-005-2892-7.
- ↑ Cullen L, Arndt G (2005). "Genome-wide screening for gene function using RNAi in mammalian cells". Immunol Cell Biol 83 (3): 217–23. PMID 15877598. doi:10.1111/j.1440-1711.2005.01332.x.
- ↑ Huesken D, Lange J, Mickanin C, Weiler J, Asselbergs F, Warner J, Meloon B, Engel S, Rosenberg A, Cohen D, Labow M, Reinhardt M, Natt F, Hall J (2005). "Design of a genome-wide siRNA library using an artificial neural network". Nat Biotechnol 23 (8): 995–1001. PMID 16025102. doi:10.1038/nbt1118.
- ↑ Ge G, Wong G, Luo B (2005). "Prediction of siRNA knockdown efficiency using artificial neural network models". Biochem Biophys Res Commun 336 (2): 723–8. PMID 16153609. doi:10.1016/j.bbrc.2005.08.147.
- ↑ Janitz M, Vanhecke D, Lehrach H (2006). "High-throughput RNA interference in functional genomics". Handb Exp Pharmacol 173 (173): 97–104. PMID 16594612. doi:10.1007/3-540-27262-3_5.
- ↑ Vanhecke D, Janitz M (2005). "Functional genomics using high-throughput RNA interference". Drug Discov Today 10 (3): 205–12. PMID 15708535. doi:10.1016/S1359-6446(04)03352-5.
- ↑ Geldhof P, Murray L, Couthier A, Gilleard J, McLauchlan G, Knox D, Britton C (2006). "Testing the efficacy of RNA interference in Haemonchus contortus". Int J Parasitol 36 (7): 801–10. PMID 16469321. doi:10.1016/j.ijpara.2005.12.004.
- ↑ Geldhof P, Visser A, Clark D, Saunders G, Britton C, Gilleard J, Berriman M, Knox D. (2007). "RNA interference in parasitic helminths: current situation, potential pitfalls and future prospects". Parasitology 134 (Pt 5): 1–11. PMID 17201997. doi:10.1017/S0031182006002071.
- ↑ Travella S, Klimm T, Keller B (2006). "RNA interference-based gene silencing as an efficient tool for functional genomics in hexaploid bread wheat". Plant Physiol 142 (1): 6–20. PMC 1557595. PMID 16861570. doi:10.1104/pp.106.084517.
- ↑ McGinnis K, Chandler V, Cone K, Kaeppler H, Kaeppler S, Kerschen A, Pikaard C, Richards E, Sidorenko L, Smith T, Springer N, Wulan T (2005). "Transgene-induced RNA interference as a tool for plant functional genomics". Methods Enzymol 392: 1–24. PMID 15644172. doi:10.1016/S0076-6879(04)92001-0.
- ↑ Paddison P, Caudy A, Hannon G (2002). "Stable suppression of gene expression by RNAi in mammalian cells". Proc Natl Acad Sci USA 99 (3): 1443–8. PMC 122210. PMID 11818553. doi:10.1073/pnas.032652399.
- ↑ Sah D (2006). "Therapeutic potential of RNA interference for neurological disorders". Life Sci 79 (19): 1773–80. PMID 16815477. doi:10.1016/j.lfs.2006.06.011.
- ↑ Zender L, Hutker S, Liedtke C, Tillmann H, Zender S, Mundt B, Waltemathe M, Gosling T, Flemming P, Malek N, Trautwein C, Manns M, Kuhnel F, Kubicka S (2003). "Caspase 8 small interfering RNA prevents acute liver failure in mice". Proc Natl Acad Sci USA 100 (13): 7797–802. PMC 164667. PMID 12810955. doi:10.1073/pnas.1330920100.
- ↑ Jiang M, Milner J (2002). "Selective silencing of viral gene expression in HPV-positive human cervical carcinoma cells treated with siRNA, a primer of RNA interference". Oncogene 21 (39): 6041–8. PMID 12203116. doi:10.1038/sj.onc.1205878.
- ↑ Crowe S (2003). "Suppression of chemokine receptor expression by RNA interference allows for inhibition of HIV-1 replication, by Martínez et al.". AIDS. 17 Suppl 4: S103–5. PMID 15080188.
- ↑ Kusov Y, Kanda T, Palmenberg A, Sgro J, Gauss-Müller V (2006). "Silencing of hepatitis A virus infection by small interfering RNAs". J Virol 80 (11): 5599–610. PMC 1472172. PMID 16699041. doi:10.1128/JVI.01773-05.
- ↑ Jia F, Zhang Y, Liu C (2006). "A retrovirus-based system to stably silence hepatitis B virus genes by RNA interference". Biotechnol Lett 28 (20): 1679–85. PMID 16900331. doi:10.1007/s10529-006-9138-z.
- ↑ Li Y, Kong L, Cheng B, Li K (2005). "Construction of influenza virus siRNA expression vectors and their inhibitory effects on multiplication of influenza virus". Avian Dis 49 (4): 562–73. PMID 16405000. doi:10.1637/7365-041205R2.1.
- ↑ Hu L, Wang Z, Hu C, Liu X, Yao L, Li W, Qi Y (2005). "Inhibition of Measles virus multiplication in cell culture by RNA interference". Acta Virol 49 (4): 227–34. PMID 16402679.
- ↑ Raoul C, Barker S, Aebischer P (2006). "Viral-based modelling and correction of neurodegenerative diseases by RNA interference". Gene Ther 13 (6): 487–95. PMID 16319945. doi:10.1038/sj.gt.3302690.
- ↑ Putral L, Gu W, McMillan N (2006). "RNA interference for the treatment of cancer". Drug News Perspect 19 (6): 317–24. PMID 16971967. doi:10.1358/dnp.2006.19.6.985937.
- ↑ Izquierdo M (2005). "Short interfering RNAs as a tool for cancer gene therapy". Cancer Gene Ther 12 (3): 217–27. PMID 15550938. doi:10.1038/sj.cgt.7700791.
- ↑ Li C, Parker A, Menocal E, Xiang S, Borodyansky L, Fruehauf J (2006). "Delivery of RNA interference". Cell Cycle 5 (18): 2103–9. PMID 16940756. doi:10.4161/cc.5.18.3192.
- ↑ Takeshita F, Ochiya T (2006). "Therapeutic potential of RNA interference against cancer". Cancer Sci 97 (8): 689–96. PMID 16863503. doi:10.1111/j.1349-7006.2006.00234.x.
- ↑ Tong A, Zhang Y, Nemunaitis J (2005). "Small interfering RNA for experimental cancer therapy". Curr Opin Mol Ther 7 (2): 114–24. PMID 15844618.
- ↑ Grimm D, Streetz K, Jopling C, Storm T, Pandey K, Davis C, Marion P, Salazar F, Kay M (2006). "Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways". Nature 441 (7092): 537–41. PMID 16724069. doi:10.1038/nature04791.
- ↑ Berkhout, B; ter Brake, O (2010). "RNAi Gene Therapy to Control HIV-1 Infection". En Caister Academic Press. RNA Interference and Viruses: Current Innovations and Future Trends. ISBN 978-1-904455-56-1.
- ↑ Sunilkumar G, Campbell L, Puckhaber L, Stipanovic R, Rathore K (2006). "Engineering cottonseed for use in human nutrition by tissue-specific reduction of toxic gossypol". Proc Natl Acad Sci USA 103 (48): 18054–9. PMC 1838705. PMID 17110445. doi:10.1073/pnas.0605389103.
- ↑ Siritunga D, Sayre R (2003). "Generation of cyanogen-free transgenic cassava". Planta 217 (3): 367–73. PMID 14520563. doi:10.1007/s00425-003-1005-8.
- ↑ Le L, Lorenz Y, Scheurer S, Fötisch K, Enrique E, Bartra J, Biemelt S, Vieths S, Sonnewald U (2006). "Design of tomato fruits with reduced allergenicity by dsRNAi-mediated inhibition of ns-LTP (Lyc e 3) expression". Plant Biotechnol J 4 (2): 231–42. PMID 17177799. doi:10.1111/j.1467-7652.2005.00175.x.
- ↑ Gavilano L, Coleman N, Burnley L, Bowman M, Kalengamaliro N, Hayes A, Bush L, Siminszky B (2006). "Genetic engineering of Nicotiana tabacum for reduced nornicotine content". J Agric Food Chem 54 (24): 9071–8. PMID 17117792. doi:10.1021/jf0610458.
- ↑ Allen R, Millgate A, Chitty J, Thisleton J, Miller J, Fist A, Gerlach W, Larkin P (2004). "RNAi-mediated replacement of morphine with the nonnarcotic alkaloid reticuline in opium poppy". Nat Biotechnol 22 (12): 1559–66. PMID 15543134. doi:10.1038/nbt1033.
- ↑ Zadeh A, Foster G (2004). "Transgenic resistance to tobacco ringspot virus". Acta Virol 48 (3): 145–52. PMID 15595207.
- ↑ Niggeweg R, Michael A, Martin C (2004). "Engineering plants with increased levels of the antioxidant chlorogenic acid". Nat Biotechnol 22 (6): 746–54. PMID 15107863. doi:10.1038/nbt966.
- ↑ Sanders R, Hiatt W (2005). "Tomato transgene structure and silencing". Nat Biotechnol 23 (3): 287–9. PMID 15765076. doi:10.1038/nbt0305-287b.
- ↑ Chiang C, Wang J, Jan F, Yeh S, Gonsalves D (2001). "Comparative reactions of recombinant papaya ringspot viruses with chimeric coat protein (CP) genes and wild-type viruses on CP-transgenic papaya". J Gen Virol 82 (Pt 11): 2827–36. PMID 11602796.
- ↑ Matson RS (2005). CRC Press, ed. Applying genomic and proteomic microarray technology in drug discovery. ISBN 0-8493-1469-0.
- ↑ 141,0 141,1 Zhang XHD (2011). Cambridge University Press, ed. Optimal High-Throughput Screening: Practical Experimental Design and Data Analysis for Genome-scale RNAi Research. ISBN 978-0-521-73444-8.
- ↑ Matzke MA, Matzke AJM. (2004). "Planting the Seeds of a New Paradigm.". PLoS Biol 2 (5): e133. PMC 406394. PMID 15138502. doi:10.1371/journal.pbio.0020133.
- ↑ Ecker JR, Davis RW (1986). "Inhibition of gene expression in plant cells by expression of antisense RNA". Proc Natl Acad Sci USA 83 (15): 5372–5376. PMC 386288. PMID 16593734. doi:10.1073/pnas.83.15.5372.
- ↑ Napoli C, Lemieux C, Jorgensen R (1990). "Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes in trans". Plant Cell 2 (4): 279–289. PMC 159885. PMID 12354959. doi:10.1105/tpc.2.4.279.
- ↑ Romano N, Macino G (1992). "Quelling: transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences". Mol Microbiol 6 (22): 3343–53. PMID 1484489. doi:10.1111/j.1365-2958.1992.tb02202.x.
- ↑ Van Blokland R, Van der Geest N, Mol JNM, Kooter JM (1994). "Transgene-mediated suppression of chalcone synthase expression in Petunia hybrida results from an increase in RNA turnover". Plant J 6: 861–77. doi:10.1046/j.1365-313X.1994.6060861.x/abs/. (require subscrición (?)).
- ↑ Mol JNM, van der Krol AR (1991). M. Dekker, ed. Antisense nucleic acids and proteins: fundamentals and applications. pp. 4, 136. ISBN 0824785169.
- ↑ Covey S, Al-Kaff N, Lángara A, Turner D (1997). "Plants combat infection by gene silencing". Nature 385 (6619): 781–2. doi:10.1038/385781a0.
- ↑ Ratcliff F, Harrison B, Baulcombe D (1997). "A Similarity Between Viral Defense and Gene Silencing in Plants". Science 276 (5318): 1558–60. PMID 18610513. doi:10.1126/science.276.5318.1558.
- ↑ Guo S, Kemphues K (1995). "par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed". Cell 81 (4): 611–20. PMID 7758115. doi:10.1016/0092-8674(95)90082-9.
- ↑ Pal-Bhadra M, Bhadra U, Birchler J (1997). "Cosuppression in Drosophila: gene silencing of Alcohol dehydrogenase by white-Adh transgenes is Polycomb dependent". Cell 90 (3): 479–90. PMID 9267028. doi:10.1016/S0092-8674(00)80508-5.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Overview of the RNAi process, de Cambridge University's The Naked Scientists
- Animación do proceso de RNAi, de Nature
- NOVA scienceNOW explica a RNAi – Un vídeo de 15 minutos da serie Nova, emitida inicialmente en 2005.
- Silencing Genomes Arquivado 10 de agosto de 2019 en Wayback Machine. Experimentos de RNAi e bioinformatica en C. elegans educativos. Do Dolan DNA Learning Center do Cold Spring Harbor Laboratory.
- Cribado de RNAi en C. elegans en formato líquido de 96 pozos e a súa aplicación para a identificación sistemática de interaccións xenéticas (un protocolo)(en inglés)
- Dous "homes dos vermes" americanos gañan o Premio Nobel polos seus traballos sobre o ARN, do NY Times (en inglés)
- Molecular Therapy web focus: "The development of RNAi as a therapeutic strategy" , colección de artigos libres sobre a RNAi como estratexia terapéutica.
- DesiRM: Deseño de siRNA complementario e non complementario para o silenciamento de xenes
