Telomerase
| ADN polimerase ARN-dirixida | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Número EC | 2.7.7.49 | ||||||||
| Número CAS | 9068-38-6 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
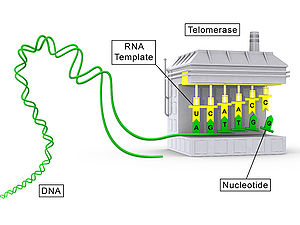

A telomerase (EC 2.7.7.49) é un complexo ribonucleoproteico que funciona como un encima con actividade polimerase, que permite o alongamento dos telómeros dos cromosomas. Está presente en células da liña xerminal, en tecidos fetais e en certas células nai pouco diferenciadas, e tamén en organismos eucariotas unicelulares. Polo contraio, nas células somáticas maduras está inactiva, xa que é reprimida en ditas células despois do nacemento, o que implica que se produce un acurtamento dos telómeros cromosómicos despois de cada división celular.
A telomerase alonga a rexión dos telómeros engadindo a secuencia repetida de ADN "TTAGGG" (en todos os vertebrados) ao extremo 3' das cadeas de ADN dos extremos dos cromosomas eucarióticos. O telómero contén secuencias repetidas de nucleótidos de ADN non codificante. O feito de non ser unha rexión codificante dificulta que se perdan secuencias importantes do ADN situadas despois do telómero, xa que en cada mitose os extremos dos cromosomas se fan máis curtos. En cada replicación do ADN só se perden 100–200 nucleótidos nos telómeros, que non son codificantes, o que non causa danos ao organismo. A telomerase ten tamén actividade de transcriptase inversa ou reversotranscitase, xa que leva a súa propia molécula de ARN, que se utiliza como molde para alongar os telómeros.
A existencia dun mecanismo de compensación para o acurtamento dos telómeros foi predito en primeiro lugar polo biólogo soviético Alexey Olovnikov en 1973,[1] que tamén suxeriu a hipótese do telómero sobre o envellecemento e as conexións do telómero co cáncer. A telomerase descubrirona Carol W. Greider e Elizabeth Blackburn en 1984 no ciliado Tetrahymena.[2] Greider e Blackburn, xunto con Jack W. Szostak foron galardoados en 2009 co Premio Nobel de Fisioloxía ou Medicina por este descubrimento.[3]
Estrutura
[editar | editar a fonte]A telomerase humana consta de telomerase reversotranscriptase (TERT), compoñente ARN da telomerase ou ARN da telomerase (TERC ou TR), e a proteína disquerina (DKC1).[4]
Os dous compoñentes principais son:
- Compoñente proteico (TERT): é a parte do encima que ten actividade de reversotranscriptase (TERT ou TRT); retrotrascribindo o ARN a ADN. Dita transcrición inversa nos telómeros é a actividade telomerase propiamente dita. A transcriptase inversa dos virus e o resto das ADN polimerases necesitan un cebador ou primer para poder sintetizar ADN, pero a telomerase funciona sen necesidade de dito cebador, xa que a TERT funciona utilizando o molde que el mesmo leva, que é TERC. O polipéptido TERT prégase co TERC, un ARN non codificante de 451 nucleótidos de longo nos humanos. O TERT ten unha estrutura tipo luva que permite que se envolva arredor do cromosoma para engadir unha repetición telomérica monocatenaria
- Compoñente ribonucleotídico (TERC): é o compoñente de ARN da telomerase ou ARN da telomerase, chamado TERC ou TR, que está totalmente integrado no encima. Segundo as especies, pode ter entre 146 a 1.544 nucleótidos de lonxitude (nos humanos 451). A secuencia molde do telómero adoita ter unha lonxitude de entre 9 e 28 nucleótidos e é característica de cada especie.
Os xenes das subunidades da telomerase son o xene TERT,[5] TERC,[6] o DKC1,[7] o TEP1,[8] etc., que están localizados en diferentes cromosomas do xenoma humano. O xene humano TERT (hTERT) é traducido a unha proteína de 1132 aminoácidos.[9] Foron secuenciadas as proteínas TERT de moitos eucariotas.[10]

A composición proteica da telomerase humana foi identificada en 2007 por Scott Cohen e o seu equipo en Australia.[4] A estrutura proteica de alta resolución da subunidade catalítica da telomerase TERT de Tribolium castaneum foi obtida en 2008 por Emmanuel Skordalakes e os seus colaboradores en Filadelfia.[11] A estrutura revelou que a proteína consta de catro dominios conservados (dominio de unión ao ARN ou TRBD, "dedos", "palma" e "polegar"), organizados nunha configuración en anel que comparte características comúns coas reversotranscriptases virais, as ARN polimerases virais e a familia B das ADN polimerases de bacteriófagos.
Función
[editar | editar a fonte]Usando TERC, o TERT pode engadir a secuencia repetida de seis nucleótidos 5'-TTAGGG (en todos os vertebrados, pero que é diferente noutros organismos) ao extremo 3' dos cromosomas. Estas repeticións TTAGGG (xunto con varias proteínas de unión asociadas) son as que forman os telómeros. A rexión molde de TERC é 3'-CAAUCCCAAUC-5'.[12] Deste modo, a telomerase pode unir os primeiros nucleótidos do molde á última secuencia do telómero no cromosoma, e engadir unha nova secuencia repetida (5'-GGTTAG-3'), realiña o novo extremo 3' do telómero ao molde, e repite o proceso.
Implicacións médicas
[editar | editar a fonte]Envellecemento
[editar | editar a fonte]O encima telomerase permite a reposición dos fragmentos de ADN dos telómeros, que doutro modo se acurtarían en cada mitose.
En circunstancias normais, é dicir, se non está presente a telomerase, cando a célula se divide sucesivamente, en certo momento toda a proxenie chegará ao seu límite de Hayflick.[13] Cando a telomerase está presente, cada célula en división pode rexenerar os fragmentos perdidos de ADN nos telómeros, e pode dividirse ilimitadamente. Aínda que esta capacidade de división ilimitada espertou moito interese nos investigadores, tamén se sinalou que esta propiedade de crecemento ilimitado é un paso fundamental para o establecemento de cánceres.
As células nai embrionarias expresan a telomerase, o que lles permite dividirse repetidamente e formar o novo individuo. Nos adultos a maioría das células somáticas apenas a expresan.
Varias síndromes de envellecemento prematuro están asociadas co acurtamento dos telómeros.[14] Entre eles están a síndrome de Werner, ataxia telanxiectasia, trastorno similar á ataxia-telanxiectasia, síndrome de Bloom, anemia de Fanconi, e síndrome de rotura de Nijmegen. Os xenes que están mutados nestas doenzas teñen todos funcións na reparación do ADN, e o seu papel exacto no mantemento da lonxitude dos telómeros é unha área moi activa de investigación.
Aínda que non se coñece actualmente ata que punto a erosión dos telómeros contribúe ao proceso normal de envellecemento, ao mantemento do ADN en xeral, e do ADN telomérico máis especificamente, dáselle grande importancia na teoría do envellecemento.
Algúns experimentos cuestionan que a telomerase se poida utilizar na terapia antienvellecemento, principalmente, polo feito de que nos ratos os elevados niveis de telomerase aumentan a incidencia do cáncer e, por tanto, non aumentan a esperanza de vida.[15] Un estudo mostrou que a activación da telomerase en ratos resistentes ao cáncer ao sobreexpresar a súa subunidade catalítica estende a vida.[16].
A exposición de linfocitos T de persoas infectadas con VIH ao activador da telomerase TAT2 retarda o acurtamento dos telómeros, incrementa o potencial proliferativo, e amplía a produción de citocinas/quimiocinas e a actividade antiviral.[17]
Un estudo realizado entre xudeus asquenacís encontrou que os que vivían máis herdaban unha versión hiperactiva da telomerase que reconstruía os telómeros.[18]
Os ratos preparados por enxeñaría xenética que tiñan bloqueado o xene que produce a telomerase a non ser que se lles administrase certa droga, envellecían moito máis rapidamente e morrían en seis meses, en lugar de atinguir a vida media dos ratos de 3 anos. A administración da droga aos 6 meses volvía a iniciar a produción de telomerase e causaba que os seus órganos "rexuveneceran", recobraban a fertilidade, e normalizaban a súa capacidade de detectar cheiros. Estes achados dan unha esperanza para o tratamento de enfermidades como a proxeria e outros trastornos do envellecemento, e ás terapias de rexeneración de órganos danados, como o fígado na hepatite ou alcoholismo.[19]
Un estudo publicado en Nature en 2011 encontrou que a reactivación da telomerase revertía a dexeneración dos tecidos en ratos vellos deficientes en telomerase.[20][21]
Cáncer
[editar | editar a fonte]As células que experimentan moitas divisións acortan os seus telómeros. A perda dos telómeros ten como resultado a aparición de mutacións e defectos que dan orixe á morte celular programada. Algunhas veces ten lugar unha mutación que activa o xene da telomerase, de maneira que as células se poden dividir indefinidamente. As células cancerosas teñen descontrolado o seu ciclo celular e tamén a súa telomerase está activa, polo que poden dividirse sen parar superando o límite de Hayflick e orixinan un tumor.
Un bo exemplo de "inmortalidade" da célula cancerosa é a liña de células HeLa, que se levan utilizando nos laboratorios desde 1951 (proceden dunha liña de células de cáncer de útero dunha muller que morreu aquel ano).
Aínda que este método de modelizar o cáncer humano en células en cultivo é efectivo e foi utilizado durante moitos anos polos científicos, tamén é moi impreciso. Os cambios exactos que permiten a formación de clons tumorixénicos non está claro. Os científicos puideron despois abordar esta cuestión pola introdución serial de varias mutacións presentes nunha variedade de cánceres humanos. Isto levou á dilucidación de varias combinacións de mutacións que son suficientes para a formación de células tumorixénicas, en varios tipos celulares. A combinación varía co tipo celular, pero unha característica común é que se requiren as seguintes alteracións: activación de TERT, perda da función da vía da p53, e da vía da pRb, activación das subfamilias Ras ou myc de protooncoxenes, e aberracións na PP2A proteína fosfatase. Ou dito doutro modo, a célula activou a telomerase, eliminou o proceso de morte celular por inestabilidade ou perda cromosómicas, ausencia de vías de indución da apoptose, e activación continua da mitose.
Este modelo do cáncer en células en cultivo describe axeitadamente o papel da telomerase nos tumores humanos reais. A activación da telomerase foi observada no ~90% dos tumores humanos estudados,[22] o que suxire que a inmortalidade conferida pola telomerase xoga un papel chave no desenvolvemento do cáncer. Dos tumores que non activan o TERT,[23] a maioría encontran unha vía alternativa para manter a lonxitude dos telómeros denominada ALT (Alternative Lengthening of Telomeres, Alongamento Alternativo dos Telómeros).[24] O mecanismo exacto que está detrás do mantemento dos telómeros na vía ALT non foi dilucidado, pero probablemente implica múltiples eventos de recombinación no telómero.
Ademais de no mantemento dos telómeros, Elizabeth Blackburn et al. informaron doutras funcións deste encima, como a activación duns 70 xenes que se sospeita que interveñen no crecemento do cáncer e a súa diseminación polo corpo, e na activación da glicólise, o que permite ás células cancerosas un rápido uso do azucre para fornecer as necesidades da súa rápida taxa de crecemento (aproximadamente comparable á dun feto).[25]
Papel noutras doenzas
[editar | editar a fonte]Observouse que a actividade da telomerase está incrementada nas zonas onde se bloquean as arterias coronarias, ou cando se está en estrés psicolóxico.[26] Un estudo de 2010 encontrou que había unha "significativamente maior" actividade de telomerase en participantes dun estudo que estiveron retirados meditando durante tres meses comparados co grupo de control.[27]
A deficiencia de telomerase foi asociada coa diabetes mellitus e a deficiente secreción de insulina en ratos, debido á perda das células produtoras de insulina do páncreas[28].
En 2005 as mutacións en TERT foron implicadas en predispoñer aos pacientes á anemia aplástica, un trastorno no cal a medula ósea deixa de producir células sanguíneas.[29]
A síndrome cri du chat é un trastorno que implica a perda da porción distal do brazo curto do cromosoma 5. O TERT está localizado na rexión delecionada, e suxeriuse que a perda dunha copia de TERT pode seu unha das causas ou factor que contribúe a esta doenza.[30]
A disqueratose conxénita é unha enfermidade da medula ósea que pode ser causada por algunhas mutacións nas subunidades da telomerase.[31] Arredor do 35% casos desta doenza están ligados ao locus DKC1 do cromosoma X (carácter recesivo)[32] e o 5% dos casos son autosómicos dominantes nos loci TERT [33] e TERC[34].
As persoas con mutacións en TERC ou DKC1 teñen telómeros máis curtos e actividade da telomerase defectiva in vitro comparados con outros individuos da mesma idade.[35][36]
A telomerase como unha potencial diana de drogas
[editar | editar a fonte]A telomerase é necesaria para a inmortalidade das células de moitos tipos de cáncer, polo que se pensa que pode ser unha potencial diana de fármacos. Se un fármaco pode utilizarse para desactivar a telomerase nas células cancerosas, o proceso de acurtamento dos telómeros faría que estes se perdesen despois de continuas divisións, o que danaría as células cancerosas.
Probáronse algunhas terapias con drogas experimentais e vacinas que teñen como obxectivo a telomerase en ratos, e algunhas pasaron á fase inicial de ensaios clínicos. Geron Corporation está actualmente realizando ensaios clínicos en humanos que implican a inhibición da telomerase e a vacinación contra a telomerase. Merck, con licenza de Geron, está probando unha vacina utilizando tres enfoques distintos. Unha vacina está baseada nun adenovirus/plásmido (Merck IND). A segunda está baseada en células dendríticas autólogas (GRNVAC1), (antes denominada TVAX cando foi probada para o cáncer de próstata). A terceira baséase en células dendríticas derivadas de células nai e está na fase preclínica.
Estes métodos de vacinación tratan de ensinar ao sistema inmunitario humano a atacar as células que expresen a telomerase. A droga inhibidora da telomerase GRN163L intenta parar a proliferación do cáncer inhibindo a telomerase e está na fase inicial de ensaios clínicos. A inhibición da telomerase en moitos tipos de células cancerosas en cultivo leva á morte masiva da poboación celular. Porén, estas terapias complícanse por unha serie cuestións, como a presenza da vía ALT [23][24]. A GNR163L únese directamente ao molde de ARN da telomerase. Con ese molde alterado a telomerase non pode alongar os telómeros e, por tanto, non pode garantir a inmortalidade replicativa do cáncer, e impide a iniciación da glicólise, e non activa os 70 xenes canceríxenos atopados por Blackburn.
Notas
[editar | editar a fonte]- ↑ Olovnikov AM (1973). "A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon". J. Theor. Biol. 41 (1): 181–90. PMID 4754905. doi:10.1016/0022-5193(73)90198-7.
- ↑ Greider CW, Blackburn EH (1985). "Identification of a specific telomere terminal transferase activity in Tetrahymena extracts". Cell 43 (2 Pt 1): 405–13. PMID 3907856. doi:10.1016/0092-8674(85)90170-9.
- ↑ "The Nobel Prize in Physiology or Medicine 2009". The Nobel Foundation. 2009-10-05. Consultado o 2010-10-23.
- ↑ 4,0 4,1 Cohen S, Graham M, Lovrecz G, Bache N, Robinson P, Reddel R (2007). "Protein composition of catalytically active human telomerase from immortal cells". Science 315 (5820): 1850–3. PMID 17395830. doi:10.1126/science.1138596.
- ↑ HUGO Gene Nomenclature Committee(HGNC) Arquivado 17 de agosto de 2010 en Wayback Machine.- TERT Arquivado 05 de outubro de 2012 en Wayback Machine.
- ↑ HGNC - TERC Arquivado 09 de outubro de 2012 en Wayback Machine.
- ↑ HGNC - DKC1 Arquivado 10 de outubro de 2012 en Wayback Machine.
- ↑ HGNC - TEP1 Arquivado 18 de outubro de 2012 en Wayback Machine.
- ↑ NCBI - telomerase reverse transcriptase isoform 1
- ↑ NCBI - telomerase reverse transcriptase
- ↑ Gillis AJ, Schuller AP, Skordalakes E (2008). "Structure of the Tribolium castaneum telomerase catalytic subunit TERT". Nature 455 (7213): 633–7. PMID 18758444. doi:10.1038/nature07283.
- ↑ Gavory G, Farrow M, Balasubramanian S (2002). "Minimum length requirement of the alignment domain of human telomerase RNA to sustain catalytic activity in vitro". Nucleic Acids Res. 30 (20): 4470–80. PMC 137139. PMID 12384594. doi:10.1093/nar/gkf575.
- ↑ Hayflick L, Moorhead PS (1961). "The serial cultivation of human diploid cell strains". Exp Cell Res 25 (3): 585–621. PMID 13905659. doi:10.1016/0014-4827(61)90192-6.
- ↑ Blasco MA (2005). "Telomeres and human disease: ageing, cancer and beyond". Nat. Rev. Genet. 6 (8): 611–22. PMID 16136653. doi:10.1038/nrg1656.
- ↑ de Magalhães JP, Toussaint O (2004). "Telomeres and telomerase: a modern fountain of youth?". Rejuvenation Res 7 (2): 126–33. PMID 15312299. doi:10.1089/1549168041553044.
- ↑ Tomás-Loba A, Flores I, Fernández-Marcos PJ, Cayuela ML, Maraver A, Tejera A, Borrás C, Matheu A, Klatt P, Flores JM, Viña J, Serrano M, Blasco MA (2008). "Telomerase reverse transcriptase delays aging in cancer-resistant mice". Cell 135 (4): 609–22. PMID 19013273. doi:10.1016/j.cell.2008.09.034.
- ↑ Fauce SR, Jamieson BD, Chin AC, Mitsuyasu RT, Parish ST, Ng HL, Kitchen CM, Yang OO, Harley CB, Effros RB (2008). "Telomerase-Based Pharmacologic Enhancement of Antiviral Function of Human CD8+ T Lymphocytes". J. Immunol. 181 (10): 7400–6. PMC 2682219. PMID 18981163.
- ↑ Atzmon G, Cho M, Cawthon RM, Budagov T, Katz M, Yang X, Siegel G, Bergman A, Huffman DM, Schechter CB, Wright WE, Shay JW, Barzilai N, Govindaraju DR, Suh Y (2010). "Genetic variation in human telomerase is associated with telomere length in Ashkenazi centenarians". Proc. Natl. Acad. Sci. U.S.A. 107 Suppl 1 (suppl_1): 1710–7. PMC 2868292. PMID 19915151. doi:10.1073/pnas.0906191106. Resumo divulgativo – LiveScience.
- ↑ Jaskelioff M, Muller FL, Paik JH, Thomas E, Jiang S, Adams AC, Sahin E, Kost-Alimova M, Protopopov A, Cadiñanos J, Horner JW, Maratos-Flier E, Depinho RA (2010). "Telomerase reactivation reverses tissue degeneration in aged telomerase deficient mice". Nature 469 (7328): 102–6. PMC 3057569. PMID 21113150. doi:10.1038/nature09603. Resumo divulgativo – news.discovery.com.
- ↑ http://www.nature.com/nature/journal/v469/n7328/full/nature09603.html
- ↑ "Stop, rewind: the scientists slowing the ageing process". BBC News. 2011-01-26.
- ↑ Shay JW, Bacchetti S (1997). "A survey of telomerase activity in human cancer". Eur. J. Cancer 33 (5): 787–91. PMID 9282118. doi:10.1016/S0959-8049(97)00062-2.
- ↑ 23,0 23,1 Bryan TM, Englezou A, Gupta J, Bacchetti S, Reddel RR (1995). "Telomere elongation in immortal human cells without detectable telomerase activity". EMBO J. 14 (17): 4240–8. PMC 394507. PMID 7556065.
- ↑ 24,0 24,1 Henson JD, Neumann AA, Yeager TR, Reddel RR (2002). "Alternative lengthening of telomeres in mammalian cells". Oncogene 21 (4): 598–610. PMID 11850785. doi:10.1038/sj.onc.1205058.
- ↑ Blackburn EH (2005). "Telomeres and telomerase: their mechanisms of action and the effects of altering their functions". FEBS Lett. 579 (4): 859–62. PMID 15680963. doi:10.1016/j.febslet.2004.11.036.
- ↑ Epel ES, Lin J, Dhabhar FS, Wolkowitz OM, Puterman E, Karan L, Blackburn EH (2010). "Dynamics of telomerase activity in response to acute psychological stress". Brain Behav Immun 24 (4): 531–9. PMC 2856774. PMID 20018236. doi:10.1016/j.bbi.2009.11.018.
- ↑ Psychoneuroendocrinology. 2010 Oct 29. Intensive meditation training, immune cell telomerase activity, and psychological mediators. Jacobs TL, Epel ES, Lin J, Blackburn EH, Wolkowitz OM, Bridwell DA, Zanesco AP, Aichele SR, Sahdra BK, Maclean KA, King BG, Shaver PR, Rosenberg EL, Ferrer E, Wallace BA, Saron CD.
- ↑ Doreen Kuhlow, Simone Florian, ..., Karl-Lenhard Rudolph, Michael Ristow (2010). "Telomerase deficiency impairs glucose metabolism and insulin secretion" (PDF). Aging 2 (2): 650–658. PMC 2993795. PMID 20876939. Arquivado dende o orixinal (PDF) o 25 de abril de 2012. Consultado o 15 de xullo de 2012.
- ↑ Yamaguchi H, Calado RT, Ly H, Kajigaya S, Baerlocher GM, Chanock SJ, Lansdorp PM, Young NS (2005). "Mutations in TERT, the gene for telomerase reverse transcriptase, in aplastic anemia". N. Engl. J. Med. 352 (14): 1413–24. PMID 15814878. doi:10.1056/NEJMoa042980.
- ↑ Zhang A, Zheng C, Hou M, Lindvall C, Li KJ, Erlandsson F, Björkholm M, Gruber A, Blennow E, Xu D (2003). "Deletion of the Telomerase Reverse Transcriptase Gene and Haploinsufficiency of Telomere Maintenance in Cri du Chat Syndrome". Am. J. Hum. Genet. 72 (4): 940–8. PMC 1180356. PMID 12629597. doi:10.1086/374565.
- ↑ Yamaguchi H (2007). "Mutations of telomerase complex genes linked to bone marrow failures". J Nippon Med Sch 74 (3): 202–9. PMID 17625368. doi:10.1272/jnms.74.202.
- ↑ Heiss NS, Knight SW, Vulliamy TJ, Klauck SM, Wiemann S, Mason PJ, Poustka A, Dokal I (1998). "X-linked dyskeratosis congenita is caused by mutations in a highly conserved gene with putative nucleolar functions". Nat. Genet. 19 (1): 32–8. PMID 9590285. doi:10.1038/ng0598-32.
- ↑ Vulliamy TJ, Walne A, Baskaradas A, Mason PJ, Marrone A, Dokal I (2005). "Mutations in the reverse transcriptase component of telomerase (TERT) in patients with bone marrow failure". Blood Cells Mol. Dis. 34 (3): 257–63. PMID 15885610. doi:10.1016/j.bcmd.2004.12.008.
- ↑ Vulliamy T, Marrone A, Goldman F, Dearlove A, Bessler M, Mason PJ, Dokal I (2001). "The RNA component of telomerase is mutated in autosomal dominant dyskeratosis congenita". Nature 413 (6854): 432–5. PMID 11574891. doi:10.1038/35096585.
- ↑ Marrone A, Walne A, Dokal I (2005). "Dyskeratosis congenita: telomerase, telomeres and anticipation". Curr. Opin. Genet. Dev. 15 (3): 249–57. PMID 15917199. doi:10.1016/j.gde.2005.04.004.
- ↑ Armanios M, Chen JL, Chang YP, Brodsky RA, Hawkins A, Griffin CA, Eshleman JR, Cohen AR, Chakravarti A, Hamosh A, Greider CW (2005). "Haploinsufficiency of telomerase reverse transcriptase leads to anticipation in autosomal dominant dyskeratosis congenita". Proc. Natl. Acad. Sci. U.S.A. 102 (44): 15960–4. PMC 1276104. PMID 16247010. doi:10.1073/pnas.0508124102.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- T.A. Sciences live Q&A Event on Telomere Video on Demand event[Ligazón morta]
- The Telomerase Database - A Web-based tool for telomerase research. Arquivado 19 de abril de 2021 en Wayback Machine.
- Three-dimensional model of telomerase at MUN
- Telomeres and Telomerase: Their Implications in Human Health and Disease on-line lecture by Elizabeth Blackburn
