Ácido glicurónico
| Ácido glicurónico | |
|---|---|
 | |
 | |
Ácido (2S,3S,4S,5R,6R)-3,4,5,6-tetrahidroxioxano-2-carboxílico | |
Outros nomes Ácido β-D-glicopiranurónico | |
| Identificadores | |
| Número CAS | 6556-12-3 |
| PubChem | 441478 |
| ChemSpider | 392615 |
| UNII | 8A5D83Q4RW |
| DrugBank | DB03156 |
| KEGG | C00191 |
| MeSH | Glucuronic+acid |
| ChEBI | CHEBI:28860 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C6H10O7 |
| Masa molar | 194,14 g mol−1 |
| Punto de fusión | 159–161 °C[1] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O ácido glicurónico ou ácido glucurónico (do antigo grego urina doce) é un azucre ácido derivado da glicosa no cal o carbono 6 está oxidado formando un grupo carboxilo COOH, que substitúe ao CH2OH que ten alí a glicosa, polo que é un ácido urónico.
Os sales e ésteres do ácido glicurónico coñécense como glicuronatos; e o anión C6H9O7− denomínase ión glicuronato.
O ácido glicurónico non debe confundirse co ácido glicónico, un ácido carboxílico liñal orixinado pola oxidación dun carbono diferente da glicosa.
A diferenza do seu epímero no carbono 5, o ácido idurónico, que pode aparecer en varias conformacións distintas, o ácido glicurónico aparece predominantemente na conformación 4C1.[2]
Os encimas glicuronidases son os encargados de hidrolizar o enlace glicosídico entre o ácido glicurónico e outros compostos.
Funcións
[editar | editar a fonte]Glicosaminoglicanos e proteoglicanos
[editar | editar a fonte]O ácido glicurónico é un glícido común nas cadeas de glicosaminoglicanos (carbohidratos), que forman parte dos proteoglicanos. Son glicosaminoglicanos con ácido glicurónico os seguintes: ácido hialurónico, heparán sulfato, e condroitín sulfato, e é un compoñente secundario, que aparece nalgúns residuos, do dermatán sulfato e heparina. Forma parte das secrecións mucosas animais, como a saliva, e do glicocálix e a matriz extracelular, xa que é compoñente do ácido hialurónico.
Glicuronidación de substancias tóxicas
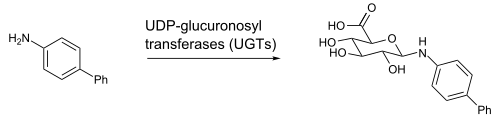
[editar | editar a fonte]No corpo dos animais o ácido glicurónico está a miúdo asociado ao metabolismo xenobiótico de certas substancias como drogas, contaminantes, bilirrubina, andróxenos, estróxenos, mineralocorticoides, glicocorticoides, derivados de ácidos graxos, retinoides, e ácidos biliares. A asociación con estas substancias implica a formación de enlaces glicosídicos, e este proceso denomínase glicuronidación.[3] A glucuronidación ocorre principalmente no fígado, aínda que o encima responsable desta catálise, a UDP-glicuroniltransferase, atópase tamén na maioría dos órganos, por exemplo, intestino, riles, cerebro, glándulas adrenais, bazo, e timo.[4][5] Na reacción mostrada o ácido glicurónico reacciona en forma de UDP-ácido glicurónico [6] coa bifenilamina, e liberaríase ao final UDP (que non se mostran na figura) e o glicuronósido.
As substancias resultantes da glicuronidación denomínanse glicurónidos (ou glicuronósidos) e son normalmente moito máis hidrosolubles ca as substancias que non conteñen ácido glicurónico a partir das cales foron sintetizadas. O corpo humano utiliza a glicuronidación para producir unha gran variedade de substancias máis hidrosolubles, e, dese xeito, facilitar a súa posterior eliminación do corpo pola urina ou as feces (por medio da bile producida polo fígado). As hormonas poden ser tamén glicuronidadas para facilitar o seu transporte polo corpo. Os farmacéuticos a miúdo enlazan fármacos co ácido glicurónico para facilitar unha administración e chegada á célula máis efectiva dun amplo número de substancias. Ás veces substancias tóxicas poden perder parte da súa toxicidade despois da glicuronidación.
A conxugación de moléculas xenobióticas con especies moleculares hidrofílicas como o ácido glicurónico coñécese como metabolismo de fase II.

Aplicacións
[editar | editar a fonte]Determinación dos esteroides urinarios e de esteroides conxugados no sangue.
Atópase na bebida kombucha, unha especie de té fermentado, onde funciona como un ácido orgánico antioxidante.[7]
En todas as plantas e nos mamíferos (excepto os cobaia e primates) o ácido glicurónico é un precursor do ácido ascórbico (vitamina C).[8] .
Notas
[editar | editar a fonte]- ↑ D-Glucuronic acid en Sigma-Aldrich
- ↑ Ferro, D. R. Provasoli, A. (1990). "Conformer populations of L-iduronic acid residues in glycosaminoglycan sequences". Carbohydr. Res. 195 (2): 157–167. PMID 2331699. doi:10.1016/0008-6215(90)84164-P.
- ↑ King C, Rios G, Green M, Tephly T (2000). "UDP-glucuronosyltransferases". Curr. Drug Metab. 1 (2): 143–61. PMID 11465080. doi:10.2174/1389200003339171.
- ↑ Ohno, Shuji; Nakajin, Shizuo (2008-10-06). "Determination of mRNA Expression of Human UDP-Glucuronosyltransferases and Application for Localization in Various Human Tissues by Real-Time Reverse Transcriptase-Polymerase Chain Reaction". Drug Metabolism and Disposition (American Society for Pharmacology and Experimental Therapeutics) 37 (1): 32–40. doi:10.1124/dmd.108.023598. Consultado o 2010-11-07.
- ↑ Bock K, Köhle C (2005). "UDP-glucuronosyltransferase 1A6: structural, functional, and regulatory aspects". Methods enzymol. 400: 57–75. PMID 16399343. doi:10.1016/S0076-6879(05)00004-2.
- ↑ PubChem compound UDP-glucuronic acid
- ↑ Dave, G.T. "Ingredients". Ingredients. Arquivado dende o orixinal o 26 de novembro de 2011. Consultado o 26 August 2011. Arquivado 26 de novembro de 2011 en Wayback Machine.
- ↑ Harvey Richard (2011). Wolters Kluwer: Lippincott Williams and Wilkins, ed. Biochemistry (5th Edition). Philadelphia. pp. 161. ISBN 978-1-60831-412-6.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Chiu SH, Huskey SW (1998). "Species differences in N-glucuronidation". Drug Metab. Dispos. 26 (9): 838–47. PMID 9733661. Arquivado dende o orixinal (abstract) o 10 de febreiro de 2009. Consultado o 25 de novembro de 2011.
- Kuehl GE, Murphy SE (2003). "N-glucuronidation of nicotine and cotinine by human liver microsomes and heterologously expressed UDP-glucuronosyltransferases". Drug Metab. Dispos. 31 (11): 1361–8. PMID 14570768. doi:10.1124/dmd.31.11.1361.
- Kuehl GE, Murphy SE (2003). "N-glucuronidation of trans-3'-hydroxycotinine by human liver microsomes". Chem. Res. Toxicol. 16 (12): 1502–6. PMID 14680362. doi:10.1021/tx034173o.
- Benowitz NL, Perez-Stable EJ, Fong I, Modin G, Herrera B, Jacob P (1999). "Ethnic differences in N-glucuronidation of nicotine and cotinine". J. Pharmacol. Exp. Ther. 291 (3): 1196–203. PMID 10565842.
- Mannfred A Hollinger, Introduction to Pharmacology, ISBN 0-415-28033-8
- Chang, K. M.; McManus, K.; Greene, J.; Byrd, G. D.; DeBethizy, J. D. Glucuronidation as a metabolic pathway for nicotine metabolism. 1991
- Coffman B.L., King C.D., Rios G.R. and Tephly T.R. The glucuronidation of opioids, other xenobiotics, and androgens by human