Pentaclorofenol
| Pentaclorofenol | |
|---|---|
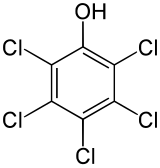 | |
2,3,4,5,6-Pentaclorofenol | |
Outros nomes Santophen, Pentachlorol, Chlorophen, Chlon, Dowicide 7, Pentacon, Penwar, Sinituho, Penta | |
| Identificadores | |
| Número CAS | 87-86-5 |
| PubChem | 992 |
| ChemSpider | 967 |
| UNII | D9BSU0SE4T |
| KEGG | C02575 |
| ChEBI | CHEBI:17642 |
| ChEMBL | CHEMBL75967 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C6HCl5O |
| Masa molar | 266,34 g mol−1 |
| Aspecto | sólido cristalino branco |
| Olor | similar ao benceno[1] |
| Densidade | 1,978 g/cm3 a 22 °C |
| Punto de fusión | 190–191 °C; 374–376 °F; 463–464 K |
| Punto de ebulición | 309–310 °C; 588–590 °F; 582–583 K |
| Solubilidade en auga | 0,020 g/L a 30 °C |
| Presión de vapor | 0,0001 mmHg (25 °C)[1] |
| Perigosidade | |
| LD50 | 117 mg/kg (rato, oral) 168 mg/kg (hámster, oral) 17 mg/kg (rata, oral) 150 mg/kg (rata, oral)[2] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O pentaclorofenol (PCP) é un composto organoclorado usado como pesticida e disinfectante. Empezouse a producir na década de 1930, e comercializouse con moitos nomes.[3] Pode encontrarse como PCP puro ou como un sal sódico de PCP, que se disolve doadamente en auga. Algunhas bacterias poden biodegradalo, como Sphingobium chlorophenolicum.
Síntese
[editar | editar a fonte]O PCP pode producirse por cloración do fenol en presenza dun catalizador (aluminio anhidro ou cloruro férrico) e aunha temperatura de aproximadamente 191 °C. Este proceso non causa unha completa cloración, polo que o PCP comercial só ten unha pureza do 84 a 90%. Os principais contaminantes son outros fenois policlorados, dibenzo-p-dioxinas policloradas, e dibenzofuranos policlorados. Algunhas destas especies químicas son aínda máis tóxicas que o propio PCP.
Usos
[editar | editar a fonte]O PCP foi utilizado como herbicida, insecticida, funxicida, alxicida, e desinfectante e como compoñente da pintura contra a bioincrustación.[3] Algunhas aplicacións son en sementes agrícolas (non para a limentación), coiro, albanelería, conservación da madeira, en augas de torres de refrixeración, cordas, e industria papeleira. O seu uso declinou debido á súa alta toxicidade e lenta biodegradación.[4]
Hai dous métodos xerais de conservar a madeira con PCP. O método do proceso a presión implica situar a madeira nunha cuba para o tratamento a presión no que se mergulla en PCP e despois se lle aplica presión. No método do proceso sen presión, o PCP aplícase como un sprai, ou fretándoo e remollándoo.
Exposición
[editar | editar a fonte]As perosas poden ser expostas ao PCP no seu lugar de traballo por inhalación do aire contaminado co produto e por contacto dérmico con produtos de madeira tratados con PCP. Ademais, a exposición da poboación xeral pode ocorrer por contacto con medios ambientes contaminados, especialmente na veciñanza de instalacións para o tratamento de madeira e vertedoiros de lixo perigoso. Ademais, outras rutas importantes de exposición parecen ser a inhalación de aire contaminado, inxestión de auga subterránea contaminada usada como fonte de auga potable, inxestión de comida contaminada, e contacto dérmico con solos ou produtos tratados con este produto.[5]
Toxicidade
[editar | editar a fonte]A exposición a curto prazo a grandes cantidades de PCP pode causar efectos nocivos no fígado, riles, sangue, pulmóns, sistema nervioso,[3] sistema inmunitario e tracto gastrointestinal. A febre, suoración profusa, movementos descoordinados, contraccións musculares e coma son efectos adicionais.
O contacto co PCP (especialmente en forma de vapor) pode irritar a pel, ollos, e boca. A exposición a longo prazo a baixos niveis como a que pode ocorrer no lugar de traballo pode causar danos ao fígado, riles, sangue e sistema nervioso.[3] Finalmente, a exposición ao PCP está tamén asociada con efectos carcinóxenos, renais, e neurolóxicos. Clasifícase na Unión Europea como carcinóxeno de categoría 3[6] e nos Estados Unidos como carcinóxeno do grupo B2 (probable carcinóxeno para os humanos).
Monitorización da exposición humana
[editar | editar a fonte]O pentaclorofenol pode ser cuantificado no plasma sanguíneo ou na urina como un índice da súa exposición excesiva. Isto realízase xeralmente por cromatografía de gas con captura electrónica ou detección por espectrometría de masas. Como a urina contén principalmente PCP conxugado en situacións de exposición crónica, recoméndase a hidrólise previa dos espécimes.[7][8][9]
Absorción en humanos e animais
[editar | editar a fonte]O PCP é rapidamente absorbido a través do tracto gastrointestinal despois da súa inxestión. A acumulación non é común, pero se ocorre, os principais sitios de acumulación son o fígado, riles, proteínas do plasma, bazo e graxas. A non ser que as funcións do fígado e riles estean alteradas, o PCP é rapidamente eliminado dos tecidos e do sangue, e excretado principalmente sen cambios ou tamén en forma conxugada, pola urina. Unha dose de PCP ten unha vida media en sangue de 30 a 50 horas en humanos. A biomagnificación do PCP na cadea trófica non se considera significativa debido á metabolización bastante rápida do composto polos organismos expostos.
Liberación no medio ambiente
[editar | editar a fonte]O PCP foi detectado en augas superficiais e sedimentos, auga da chuvia, auga potable, organismos acuáticos, solo, e alimentos, e tamén no leite humano, tecido adiposo, e urina.
A liberación deste produto no medio ambiente causou gran preocupación, pero está decrecendo como resultado do seu menor uso, cambios nos métodos de utilización ou da súa restrición ou prohibición. Porén, o PCP aínda se libera nas augas superficiais procedente da atmosfera por deposición húmida, procedente do solo por escorrentía e lixiviado, e desde as fabricas de procesamentoe manufacturación. O PCP é liberado directamente á atmosfera por volatilización de produtos de madeira tratada e durante a súa produción. Finalmente, as liberacións no solo poden deberse a lixiviado desde produtos de madeira tratados, deposición atmosférica por precipitacións (chuvia, neve), verteduras de industrias ou de vertedoiros de substancias perigosas.
Unha vez que se libera o PCP á atmosfera, descomponse por fotólise. A principal vía degradativa para o PCP é a deshaloxenación redutora. Neste proceso, o composto PCP degrádase a tetraclorofenois, triclorofenois, e diclorofenois. Outra vía é a metilación do pentacloroanisol (un composto máis liposoluble). Estes dous métodos finalmente causan a clivaxe do anel da molécula e a súa completa degradación.
En augas pouco fondas o PCP é tamén eliminado rapidamente por fotólise. En augas fondas ou turbias teñen lugar procesos como a sorción e biodegradación. En solos redutores e sedimentos o PCP pode ser degradado nun período de 14 días a 5 anos, dependendo das bacterias anaerobias do solo que estean presentes. Porén, a adsorción de PCP nos solos depende do pH porque se incrementa en condicións ácidas e diminúe en condicións neutras e básicas.
Prohibición
[editar | editar a fonte]En maio de 2015, os países que asinaron a Convención de Estocolmo votaron por 90 votos contra 2 a favor da prohibición do uso do pentaclorofenol. Non obstante, algúns países importante non son sinatarios deste acordo, como Estados Unidos,[10] pero aínda así o seu uso nese país está restrinxido ao tratamento de postes e travesas de ferrocarril de madeira, a súa presenza na auga é controlada[3] e para a súa eliminación está considerado lixo perigoso.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 "NIOSH Pocket Guide to Chemical Hazards #0484". National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Pentachlorophenol". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 3,0 3,1 3,2 3,3 3,4 "Consumer Factsheet on: Pentachlorophenol". United States Environmental Protection Agency. 2006-11-28. Consultado o 2008-02-26.
- ↑ Fiege, H.; Voges, H.-M.; Hamamoto, T; Umemura, S.; Iwata, T.; Miki, H.; Fujita, Y.; Buysch, H.-J.; Garbe, D.; Paulus, W. (2000). "Phenol Derivatives". Ullmann's Encyclopedia of Industrial Chemistry (Weinheim: Wiley-VCH). doi:10.1002/14356007.a19_313.
- ↑ ToxFAQs for Chlorophenols Arquivado 12 de decembro de 2020 en Wayback Machine., Agency for Toxic Substances and Disease Registry
- ↑ EURlex
- ↑ Edgerton TR, Moseman RF. Determination of pentachlorophenol in urine: the importance of hydrolysis. J. Agr. Food Chem. 27: 197-199, 1979.
- ↑ ACGIH. 2009 TLVs and BEIs. American Conference of Governmental Industrial Hygienists, Cincinnati, Ohio, 2009.
- ↑ R. Baselt, Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, California, 2008, pp. 1197-1200.
- ↑ Knauss, Tim (1 June 2015). "CNY mom fights National Grid over toxin-infused backyard utility poles". syracuse.com. Consultado o 22 June 2015.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]| Commons ten máis contidos multimedia sobre: Pentaclorofenol |
- Non-CCA Wood Preservatives: Guide to Selected Resources - National Pesticide Information Center Arquivado 31 de outubro de 2007 en Wayback Machine.
- EPA on pentachlorophenol
- atsdr.cdc.gov on pentachlorophenol Arquivado 12 de decembro de 2020 en Wayback Machine.
- CDC - NIOSH Pocket Guide to Chemical Hazards
- EPA study that used the fungus Phanerochaete chrysosporium to aid in bioremediation of pentachlorophenol in soil
- EPA ReRegistration - www.regulations.gov -Search docket ID EPA-HQ-OPP-2014-0653.
