Piranosa

En bioquímica, piranosa é un termo utilizado para denominar os carbohidratos que teñen unha estrutura química cíclica formada por un anel de seis membros, que leva nos seus vértices cinco átomos de carbono e un átomo de osíxeno, ao que se unen os distintos substituíntes. O nome deriva da súa similitude estrutural co composto heterocíclico osixenado pirano, pero o anel de piranosa non ten enlaces dobres coma o pirano. Unha piranosa na que o grupo hidroxilo (OH) do carbono anomérico foi convertido nun grupo O-R denomínase piranósido.
Formación do anel de piranosa
[editar | editar a fonte]Cando os azucres de 5 ou máis carbonos están en disolución non permanecen na súa forma liñal, senón que se ciclan orixinando piranosas ou furanosas. Nos azucres aldosas de 5 e 6 carbonos en disolución o anel de piranosa orixínase por reacción do grupo hidroxilo do carbono 5 do azucre, co grupo aldehido do carbono 1 da mesma molécula. Isto forma un hemiacetal intramolecular. Polo contrario, se a reacción se establece entre o hidroxilo do carbono 4 e o grupo aldehido, fórmase unha furanosa pentagonal, o que é moito menos frecuente.[1] Nas aldohexosas a forma piranosa é termodinamicamente máis estable ca a forma furanosa, o que pode verse na distribución destas dúas formas cíclicas en solución, na cal a forma piranosa é a adoptada polo 99% das moléculas.[2]

Historia
[editar | editar a fonte]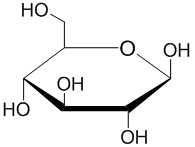
En 1902, Hermann Emil Fischer gañou o Premio Nobel de Química polos seus traballos para determinar a estrutura das D-aldohexosas.[1] Porén, as estruturas liñais de aldehido libre que Fischer propuxo representan un porcentaxe menor das formas que os azucres de hexosa adoptan en solución. Foi Edmund Hirst e Clifford Purves, no grupo de investigación de Walter Norman Haworth, os que determinaron concluintemente que os azucres de hexosa forman preferentemente unha piranosa, ou un anel de seis membros. Haworth debuxou o anel como un hexágono plano con grupos por encima e por debaixo do plano do anel, o que se denomina proxección de Haworth.[3]
Unha representación máis exacta da conformación dos aneis de piranosa chegou cando Sponsler e Dore (1926) notaron que o tratamento matemático de Sachse de aneis de seis membros podía ser aplicado á súa estrutura de raios X da celulosa.[3] Determinouse que o anel de piranosa non ten unha forma plana, que permitía que todos os átomos do anel teñan unha xeometría próxima á tetraédrica.
Conformación do anel de piranosa
[editar | editar a fonte]Debido á forma non plana do anel de piranosa, distínguense 38 conformacións básicas distintas da piranosa: 2 de cadeira, 6 de bote, 6 de bote torcido, 12 de media cadeira, e 12 de sobre.[4]

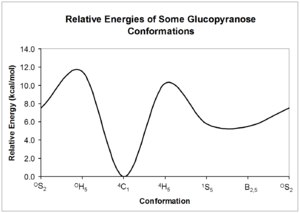
Estes confórmeros poden interconverterse uns noutros; porén, cada forma pode ter diferente enerxía relativa, así que pode presentarse unha barreira significativa para a interconversión. A energía destas conformacións pode cuantificarse a partir de cálculos de mecánica cuántica; móstrase un exemplo posible de inverconversións da glicopiranosa.[5]
As conformacións do anel de piranosa son superficialmente similares ás do anel de ciclohexano (ver Conformación do ciclohexano). Porén, a nomenclatura específica das piranosas inclúe referencias ao átomo de osíxeno do anel, e a presenza de grupos hidroxilo unidos ao anel ten diferentes efectos na súa preferencia conformacional. Tamén existen efectos conformacionais e estereoquímicos específicos ao anel de piranosa.
Nomenclatura dos aneis de piranosa
[editar | editar a fonte]
Para nomear as conformacións da piranosa, primeiro determínase o confórmero. Os confórmeros comúns son similares aos atopados no ciclohexano, e forman a base do nome. As conformacións comúns e as letras (etiquetas) que os simbolizan son: cadeira (C), bote (B), torcida (S), media cadeira (H), e sobre (E). Os átomos do anel están numerados; o carbono anomérico é sempre o 1. Os átomos de osíxeno da estrutura denomínanse con referencia ao carbono ao que están unidos na forma acíclica da molécula, e son designados por O. Ademais:
- Colócase o anel de modo que se o ollamos desde a parte superior os átomos están numerados en sentido horario. Catro átomos (ou 5 no caso da conformación de sobre) estarán no anel.
- Os átomos situados por riba do plano escríbense como superíndices antes da etiqueta do confórmero (á súa esquerda);
- Os átomos situados por debaixo do plano escríbense como subíndices despois da etiqueta do confórmero (á súa dereita).[6]
Por exemplo, 1,4B, indica o seguinte: B é a etiqueta que significa bote, e neste confórmero os átomos 1 e 4 están por riba do plano do anel (por iso se poñen antes da letra e como superíndices). Os demais carbonos están no anel e non hai ningún por debaixo do anel (se os houbese aparecerían como subíndices despois da letra). O carbono 6 non forma parte do anel.
Espectroscopia RMN de aneis de piranosa
[editar | editar a fonte]Como se mostra polas enerxías estruturais relativas no diagrama de arriba, as estruturas de cadeira son a forma máis estable do carbohidrato. Esta conformación relativamente estable e definida significa que os átomos de hidróxeno do anel de piranosa son mantidos en ángulos relativamente constantes uns doutros. A espectroscopia de resonancia magnética nuclear de carbohidratos (RMN) aproveita estes ángulos diedros para determinar a configuración de cada un dos grupos hidroxilo arredor do anel.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Robyt, J.F. (1998). Essentials of Carbohydrate Chemistry. Springer. ISBN 0387949518.
- ↑ Ma, B.Y.; Schaefer, H.F.; Allinger, N.L. (1998). "Theoretical studies of the potential energy surfaces and compositions of the D-aldo and D-ketohexoses". Journal of the American Chemical Society 120: 3411–3422.
- ↑ 3,0 3,1 Rao, V.S.R.; Qasba, P.K.; Chandrasekaran, R.; Balaji, P.V. (1998). Conformation of Carbohydrates. CRC Press. ISBN 9057023156.
- ↑ Ionescu, A.R.; Berces, A.; Zgierski, M.Z.; Whitfield, D.M.; Nukada, T. (2005). "Conformational Pathways of Saturated Six-Membered Rings. A Static and Dynamical Density Functional Study". The Journal of Physical Chemistry A 109: 8096–8105.
- ↑ Biarns, X.; Ardvol, A.; Planas, A.; Rovira, C.; Laio, A.; Parrinello, M. (2007). "The Conformational Free Energy Landscape of b-D-Glucopyranose. Implications for Substrate Preactivation in b-Glucoside Hydrolases". Journal of the American Chemical Society 129: 10686–10693.
- ↑ Furhop, J.H.; Endisch, C. (2000). Molecular and Supramolecular Chemistry of Natural Products and Their Model Compounds. CRC Press. ISBN 0824782011.
