Senescencia

A senescencia ou envellecemento biolóxico é a deterioración gradual co paso do tempo das funcións características da maior parte das formas de vida complexas, que ocorre en todos os reinos de seres vivos, e que no nivel de individuo incrementa a mortalidade despois da maduración. A palabra "senescencia" pode referirse tanto á senescencia celular coma á senescencia do organismo completo. Pénsase xeralmente que a senescencia celular é o que explica que se produza a senescencia do organismo completo. A ciencia que trata do envellecemento biolóxico é a bioxerontoloxía.
A senescencia non é o destino inevitable de todos os organismos, e pode ser atrasada. O descubrimento, en 1934, de que a restrición calórica pode ampliar a duración da vida nun 50% en ratas, e a existencia de especies que teñen senescencia desprezable e as especies potencialmente inmortais como Hydra, motivaron investigacións sobre a prevención e atraso da senescencia e das doenzas relacionadas coa idade. Os organismos dalgúns grupos taxonómicos, incluídos algúns animais, mesmo experimentan unha diminución cronolóxica da mortalidade, en todo ou en parte do seu ciclo vital.[1] No outro extremo hai tamén enfermidades de envellecemento acelerado, como a proxeria, que son raras en humanos. Existe tamén a extremadamente rara e mal coñecida "síndrome X", na cal unha persoa permanece física e mentalmente na infancia durante toda a súa vida.[2][3]
Incluso se os factores ambientais non causan o envelecemento, poden afectalo; por exemplo, a sobreexposición á radiación ultravioleta acelera o envellecemento da pel. Diferentes partes do corpo poden envellecer a distintas velocidades. Dous organismos da mesma especie poden tamén envellecer a distinta velocidade, polo que o envellecemento biolóxico e o cronolóxico son conceptos diferentes.
Non obstante, indirectamente, a senescencia é con diferenza a principal causa de morte (deixando á parte que en sentido obvio a hipoxia cerebral, é dicir, a falta de oxíxeno no cerebro, é a causa inmediata de todas as mortes). Das aproximadamente 150.000 persoas que morren cada día en todo o mundo, uns 2/3 (100.000 ao día) morren por causas relacionadas coa elevada idade; nas nacións industrializadas a proporción é moito maior, chegando ao 90%.[4]
Hai varias hipóteses para explicar por que ocorre a senescencia; por exemplo, algunhas consideran que está programada polos cambios na expresión xénica, outras que se debe ao dano acumulativo causado por procesos biolóxicos. Actualmente hai moitas especulacións científicas e investigacións sobre se a senescencia como proceso biolóxico pode ser ou non atrasada, parada ou mesmo revertida.[5]
Senescencia celular
[editar | editar a fonte]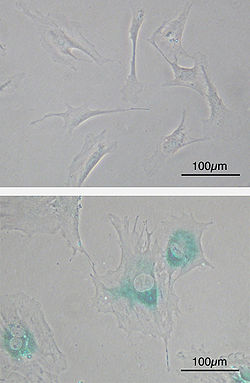
(Arriba) Fibroblastos embrionarios de rato primarios (MEFs) antes da senescencia. Con forma de fuso.
(Abaixo) Os MEFs fanse senescentes despois de 8 pasos a un novo cultivo. As células medran en tamaño, fanse aplanadas e expresan β-galactosidase asociada á senescencia (SABG, áreas azuis), un marcador celular da senescencia.
A senescencia celular é o fenómeno polo cal as células diploides normais deixan de dividirse. Os fibroblastos en cultivos celulares poden realizar un máximo de 50 divisións celulares antes de facerse senescentes. Este fenómeno coñécese como "senescencia replicativa" ou límite de Hayflick.[6] A senescencia replicativa é o resultado do acurtamento dos telómeros dos cromosomas, que finalmente desencadea unha resposta aos danos no ADN. As células poden tamén ser inducidas á senescencia polos danos ao ADN en resposta a un nivel elevado de especies reactivas do oxíxeno, a activación de oncoxenes e a fusión celular, independentemente da lonxitude dos telómeros. A senescencia celular representa un cambio no "estado celular" en vez de que simplemente a célula se fai "vella" como o nome suxire equivocamente.
Aínda que as células senescentes xa non poden replicarse, permanecen metabolicamente activas e xeralmente adoptan un fenotipo inmunoxénico que consta dun secretoma proinflamatorio, a regulación á alza de ligandos inmunes, unha resposta prosupervivencia, unha expresión xénica promiscua (pGE) e unha marcaxe positiva para a actividade de β-galactosidase asociada á senescencia.[7] O núcleo das células senescentes caracterízase por ter focos de heterocromatina asociados á senescencia (SAHF) e segmentos de ADN con alteracións da cromatina que reforzan a senescencia (DNA-SCARS).[8] As células senescentes afectan a supresión de tumores, curación de feridas e posiblemente ao desenvolvemento embrionario/placentario e a teñen un papel patolóxico en enfermidades relacionadas coa idade.[9]
A eliminación experimental de células senescentes en ratos proxeroides transxénicos[10] e non proxeroides cun envellecemento natural[11][12][13] orixina unha maior resistencia contra enfermidades asociadas ao envellecemento.
Análise do reloxo epixenético da senescencia celular
[editar | editar a fonte]Segundo un biomarcador molecular do envellecemento chamado reloxo epixenético,[14] os tres tipos principais de senescencia celular, chamados senescencia replicativa, senescencia inducida por oncoxenes e senescencia inducida por danos no ADN son distintas porque a indución da senescencia replicativa e a senescencia inducida por oncoxenes están acompañadas de envellecemento epixenético de células primarias, pero a senescencia inducida por danos no ADN non, incluso a pesar que as senescencias replicativa e inducida por oncoxenes activan a vía de resposta aos danos no ADN.[15] Estes resultados subliñan a independencia da senescencia celular do envellecemento epixenético. En concordancia con isto, as células inmortalizadas pola telomerase seguen envellecendo (segundo o reloxo epixenético) sen que foran tratadas con ningún indutor da senescencia ou axentes que danan o ADN, o que reafirma a independencia do proceso de envellecemento epixenético con respecto aos telómeros, a senescencia celular, e a vía de resposta aos danos no ADN. Aínda que o desacoplamento da senescencia do envellecemento celular parece nunha primeira ollada que é inconsistente co feito de que as células senescentes contribúan á manifestación física do envellecemento do organismo, cando se eliminan as células senescentes faise máis lento o envellecemento, como demostraron Baker et al.[10] Porén, a análise do reloxo epixenético da senescencia suxire que a senescencia celular é un estado ao que as células son forzadas como resultado de presións externas como danos no ADN, expresión ectópica de oncoxenes e proliferación exhaustiva de células para substituír as eliminadas por factores externos ou ambientais.[15] Estas células senescentes, acumuladas en número suficiente, indubidablemente causan a deterioración dos tecidos, o cal se interpreta como envellecemento do organismo. Porén, a nivel celular, o envellecemento, medido polo reloxo epixenético, é distinto da senescencia. É un mecanismo intrínseco que existe desde a formación da célula e continúa despois. Isto implica que se as células non son desviadas á senescencia polas presións externas descritas antes, aínda continuarían crecendo. Isto concorda co feito de que ratos con telómeros naturalmente longos aínda envellezan e finalmente morran mesmo se as lonxitudes dos seus telómeros son moito maiores que o límite crítico, e envellezan prematuramente cando os seus telómeros son acurtados forzadamente, debido á senescencia replicativa. Por tanto, a senescencia é unha ruta pola cal as células saen prematuramente do seu curso natural de envellecemento natural.[15]
Senescencia celular e duración da vida
[editar | editar a fonte]Como se dixo anteriormente, a senescencia non é universal. Antes pensábase que a senescencia non ocorría en organismos unicelulares que se reproducen por mitose.[16] Pero as investigacións recentes debuxan un panorama máis complexo. Unha célula pode acumular danos relacionados coa idade. Na mitose os residuos non son repartidos equitativamente entre as células fillas, senón que pasan a unha das células deixando a outra limpa. Co paso de sucesivas xeracións a poboación celular convértese nun mosaico de células a metade das cales non envelleceron e o resto ten diversos graos de senescencia.[17]
Ademais, a senescencia celular non se observa en todos os organismos, incluíndo as plantas perennes, esponxas, corais, e lagostas. Nas especies nas que se observa senescencia celular, as células finalmente convértense en posmitóticas cando xa non se poden replicar por medio de mitose; é dicir, as células experimentan senescencia replicativa. Investigouse e especulouse moito sobre como e por que algunhas células se fan posmitóticas nalgunhas especies, e tense suxerido que a senescencia celular evolucionou como un mecanismo para impedir o comezo e espallamento do cancro. As células somáticas que se dividiron moitas veces, acumulan mutacións no ADN e están en perigo de converterse en cancerosas se as divisións celulares continúan. Parece que as células senescentes sofren unha conversión a células cun fenotipo inmunoxénico que permite que sexan eliminadas polo sistema inmunitario.[18]
Ultimamente, o papel dos telómeros na senescencia celular espertou grande interese, especialmente en relación cos posibles efectos adversos xenéticos da clonación. O sucesivo acurtamento dos telómeros dos cromosomas en cada ciclo celular tamén se cre que limita o número de divisións da célula, o que contribúe ao envellecemento celular. Algunhas células non envellecen e dise que son "bioloxicamente inmortais". Algúns teorizan que se se descobre cal é a causa exacta que permite a estas células dividirse sen límite, sería posible alterar xeneticamente outras células para que tivesen a mesma capacidade, e isto podería teoricamente aplicarse, mediante terapia xénica, para parar ou reverter o envellecemento, facendo as células e, potencialmente ao organismo enteiro, inmortais.
A lonxitude dos telómeros ten efectos na senescencia; o acurtamento dos telómeros activa amplas alteracións no empalme alternativo do ARN que producen toxinas senescentes como a proxerina, que degrada o tecido e faino máis proclive a fallar na realización da súa función.[19]
As células cancerosas son xeralmente inmortais. Nun 85% dos tumores, esta evasión da senescencia celular é o resultado da activación á alza dos xenes da telomerase.[20] Esta simple observación suxire que a reactivación da telomerase en individuos saudables podería incrementar grandemente o seu risco de cancro.
Ned Sharpless e colaboradores demostraron a primeira ligazón in vivo entre células senescentes que expresan p16 e a duración da vida.[21] Atoparon un retardo na acumulación de células senescentes en ratos con mutacións que ampliaban a duración da vida, e tamén en ratos que ampliaran a duración da vida por restrición de alimentos. Posteriormente, Jan van Deursen e Darren Baker en colaboración con Andre Terzic na Clínica Mayo en Rochester, Minnesota, proporcionaron a primeira evidencia in vivo da ligazón causal entre a senescencia celular e o envellecemento ao impediren a acumulación de células senescentes en ratos proxeroides BubR1.[22] En ausencia de células senescentes, os tecidos dos ratos mostraban unha mellora importante na carga usual de trastornos relacionados coa idade. Os animais non desenvolvían cataratas, non presentaban o habitual debilitamento dos músculos coa idade, conservaban as capas de graxa na pel que normalmente se fan máis delgadas coa idade (o que nas persoas causa engurras). Jan van Deursen, James Kirkland, Tamara Tchkonia, Nathan LeBrasseur, e Darren Baker na Clínica Mayo, proporcionaron a primeira proba directa in vivo de que a senscencia celular causa signos de envellecemento ao eliminaren as células senescentes de ratos proxeroides ao introduciren un xene de suicidio inducible por fármacos e despois tratar os ratos cun fármaco que mataba selectivamente as células senescentes, en lugar de faceren diminuír o p16 en todo o corpo.[10] Outro estudo da Clínica Mayo liderado por James Kirkland en colaboración con Scripps e outros grupos demostrou que os fármacos senolíticos, que teñen como diana as células senescentes, potencian a función cardíaca e melloran a reactividade vascular en ratos vellos, alivian os trastornos ao camiñar causados pola radiación en ratos, e atrasan a fraxilidade ósea, disfunción neurolóxica e osteoporose en ratos proxeroides. O descubrimento de fármacos senolíticos debeuse a unha estratexia baseada nunha hipótese: os investigadores aproveitaron o feito de que as células senescentes son resistentes á apoptose para descubrir que as vías prosupervivencia están reguladas á alza nestas células. Demostraron que estas vías para a supervivencia son o "talón de Aquiles" das células senescentes usando interferencia de ARN; entre estas vías estaban as vías de Bcl-2, AKT, p21, e as relacionadas con tirosina quinase. Despois usaron fármacos que tiñan como diana as vías identificadas e mostraron que estes fármacos mataban as células senescentes por apoptose en cultivo e diminuían a carga de células senescentes en moitos tecidos in vivo. Un dato importante era que estes fármacos tiñan efectos a longo prazo despois dunha soa dose, o que era consistente coa eliminación das células senescentes, en vez de cun efecto temporal que requirise a presenza continua dos fármacos. Este foi o primeiro estudo que mostrou que a eliminación de células senescentes mellora o funcionamento de ratos cronoloxicamente vellos.[23]
Envellecemento de organismos completos
[editar | editar a fonte]A senescencia dun organismo é o envellecemento do organismo completo. En xeral, o envellecemento caracterízase polo declive da capacidade de responder ao estrés, un aumento do desequilibrio homeostático e un incremento do risco de enfermidades asociadas co envellecemento. A morte é a consecuencia final do envellecemento, aínda que a "ancianidade" non é recoñecida cientificamente como causa de morte, porque hai sempre unha causa próxima específica, como o cancro, enfermidade cardíaca ou insuficiencia hepática. O envellecemento de organismos completos é, por tanto, un proceso complexo que pode definirse como "unha deterioración progresiva das funcións fisiolóxicas, un proceso intrínseco relacionado coa idade de perda de viabilidade e aumento da vulnerabilidade."[24]
As diferenzas na duración da vida máxima entre especies corresponden a diferentes "velocidades de envellecemento". Por exemplo, as diferenzas herdadas bioloxicamente na velocidade e envellecemento fan que un rato sexa ancián aos 3 anos de idade e un humano o sexa aos 80 anos.[25] Estas diferenzas xenéticas afectan a diversos procesos fisiolóxicos, incluíndo a eficiencia da reparación do ADN, a dos encimas antioxidantes, e a taxa de produción de radicais libres.

A senescencia do organismo determina a lei da mortalidade de Gompertz–Makeham, que di que a taxa de mortalidade acelera rapidamente conforme aumenta a idade.
Algúns animais, como algúns réptiles e peixes, envellecen lentamente (senescencia desprezable) e presentan duracións da vida moi longas. Algúns mesmo mostran "senescencia negativa", na cal a mortalidade diminúe coa idade, en desacordo coa "lei" de Gompertz–Makeham.[1]
Investígase activamente se a senescencia replicativa (límite de Hayflick) ten un papel causal no envellecementodo organismo.
O moi citado teórico evolutivo George Williams escribiu o seguinte: "É salientable que despois da aparentemente milagrosa fazaña da morfoxénese, un metazoo complexo sexa incapaz de realizar a tarefa moito máis sinxela de simplemente manter o que xa está formado."[26]
Actualmente hai un debate sobre se a procura da lonxevidade e a posposición da senescencia son obxectivos de coidado da saúde rendibles ou viables para os sistemas sanitrios dados os recursos finitos que hai para o coidado da saúde. Debido á acumulación de enfermidades na vellez, o bioético Ezekiel Emanuel opina que o propósito da lonxevidade segundo a hipótese da compresión da morbilidade é unha "fantasía" e que a vida humana non vale a pena prolongala artificialmente despois dos 75 anos; segundo esta interpretación, a lonxevidade non debería ser un obxectivo nas políticas sanitarias.[27] Esta opinión foi refutada polo neurocirurxián e ético médico Miguel Faria, que sinalou que a vida pode valer a pena vivila na ancianidade, e que a lonxividade debería procurarse en asociación con alcanzar unha calidade de vida.[28] Faria sostén que a posposición da senescencia e a felicidade e sabedoría poden alcanzarse na vellez nunha gran proporción dos individuos que levan estilos de vida saudables e permanecen intelectualmente activos.[29]
Teorías do envellecemento
[editar | editar a fonte]A etioloxía exacta da senescencia aínda non está moi clara e queda moito por descubrir. O proceso de senescencia é complexo, e pode derivar de varios mecanismos diferentes e diversas causas. Porén, a senescencia non é universal. Nunhas poucas especies simples, como as dos xénero de cnidarios Hydra, a senescencia é desprezable e non se pode detectar. Todas esas especies non teñen células "posmitóticas" e reducen o efecto dos danos por radicais libres. Outro mecanismo relacionado é o das planarias, vermes planos bioloxicamente inmortais, que teñen unha "capacidade rexenerativa dos telómeros aparentemente ilimitada alimentada por unha poboación de células nai adultas altamente proliferativas."[30] Estes organismos son bioloxicamente inmortais, pero non inmortais no senso tradicional, xa que son susceptibles a sufrir traumas físicos e doenzas infecciosas e non infecciosas, que os matan. Ademais, a duración da vida media pode variar grandemente entre especies. Isto suxire que contribúen ao envellecemento tanto factores ambientais coma xenéticos.
En xeral, as teorías que explican a senescencia foron divididas en teorías programadas e estocásticas do envellecemento. As teorías programadas implican que o envellecemento está regulado por reloxos biolóxicos que funcionan durante toda a vida. Esta regulación depende de cambios na expresión xénica que afectan os sistemas responsables do mantemento, reparación e respostas de defensa. A teoría do ciclo celular-reprodutiva suxire que o envellecemento está causado por cambios na sinalización hormonal sobre a duración da vida.[31] As teorías estocásticas culpan os impactos ambientais sobre os organismos vivos que inducen danos acumulativos a varios niveis de ser a causa do envellecemento, exemplos dos cales van desde os danos no ADN, danos en tecidos e células por radicais do oxíxeno (radicais libres contrarrestados normalmente por antioxidantes), e enlaces cruzados no ADN.
Porén, o envellecemento considérase un fallo progresivo da preservación homeodinámica–sistémica da homeostase, que implica a xenes para o mantemento e a reparación, eventos estocásticos que orixinan danos moleculares e heteroxeneidade molecular, e eventos casuais que determinan a probabilidade de morte. En 2013, un grupo de científicos definiu nove marcas definitorias do envellecemento que son comúns entre distintos organismos, poñendo a énfase en mamíferos, que eran: inestabilidade xenómica, erosión dos telómeros, alteracións epixenéticas, perda da proteostase, desregulación da percepción dos nutrientes, disfunción mitocondrial, senescencia celular, esgotamento das células nas e alteración da comunicación intercelular.[32]
Teorías evolutivas
[editar | editar a fonte]- Artigo principal: Evolución do envellecemento.
Un xene pode expresarse en varios estadios da vida. Por tanto, a selección natural pode manter alelos prexudiciais ou mesmo letais se a súa expresión ocorre despois da reprodución. A senescencia pode ser o produto de tal selección.[33][34][35] Ademais, crese que o envellecemento evolucionou debido á probabilidade cada vez menor de que un organismo siga vivo conforme se vai facendo vello, debido á predación e accidentes, os cales poden ambos ser aleatorios e independentes da idade. A teoría da pleiotropía antagonista establece que as estratexias, que teñen como resultado unha taxa reprodutiva maior a unha idade xove, pero unha duración da vida global máis curta, orixinan un maior éxito reprodutivo durante a vida e son, por tanto, favorecidas pola selección natural. En esencia, o envellecemento é, por tanto, o resultado de investir recursos na reprodución, en vez de no mantemento do corpo (a teoría do "soma prescindible"[36]), dado que os accidentes, a predación e as enfermidades matan os organismos independentemente de canta enerxía se dedica a reparar o corpo. Hai outras teorías do envellecemento e non son necesariamente mutuamente excluíntes.
O xenetista J. B. S. Haldane preguntábase por que a mutación dominante que causa a enfermidade de Huntington permanecía na poboación, e por que a selección natural non a eliminara xa. O inicio desta enfermidade neurolóxica prodúcese como media á idade de 45 anos e é invariablemente mortal nun período de 10 a 20 anos. Haldane asumiu que, na prehistoria humana, poucos individuos sobrevivían ata os 45 anos. Como eran poucos os que vivían ata idades vellas e a súa contribución á seguinte xeración era relativamente máis pequena que as grandes cohortes dos individuos dos grupos de idades novas, a forza da selección contra tales mutacións deletéreas que actúan tardiamente era consecuentemente pequena. Ao contrario, se unha mutación afectaba aos individuos xoves, a selección na súa contra sería forte. Por tanto, as mutacións deletéreas que actúan tardiamente poderían acumularse nas poboacións ao longo do tempo evolutivo por medio da deriva xenética, o que se demostrou experimentalmente. Este concepto de maior acumulación de mutacións deletéreas nos individuos vellos coñeceuse como sombra selectiva.[37]
Peter Medawar formalizou esta observación na súa teoría de acumulación de mutacións do envellecemento.[38][39] "A forza da selección natural debilítase conforme aumenta a idade, mesmo nunha poboación teoricamente inmortal, só con tal que sexa exposta aos perigos reais da mortalidade. Se un desastre xenético... ocorre o suficientemente tarde na vida individual, as súas consecuencias poden carecer totalmente de importancia". Os 'perigos reais para a mortalidade' son, en circunstancias normais, a predación, as enfermidades e os accidentes. Deste modo, mesmo unha poboación inmortal, cuxa fertilidade non declina con tempo, terá poucos individuos vivos nos grupos de idade vellos. Isto denomínase 'mortalidade extrínseca'. As cohortes de idades novas, cuxo número non foi diminuído aínda pola mortalidade extrínseca, contribúen moito máis á seguinte xeración que os poucos que quedan das cohortes de idades vellas, así que a forza da selección contra mutacións deletéreas que actúan tardiamente, que afectan só a estes poucos individuos vellos, é moi feble. As mutacións poden, pois, non sufrir unha selección en contra, e poden espallarse na poboación no tempo evolutivo.
A principal predición comprobable feita por este modelo é que as especies que teñen unha mortalidade extrínseca alta na natureza envellecerán máis rapidamente e terán unha duración da vida máis curta. Isto foi confirmado nos mamíferos, os mellor estudados na historia da vida. Hai unha correlación nos mamíferos entre o tamaño do corpo e a duración da vida, de modo que as especies máis grandes viven máis tempo que as especies máis pequenas baixo as condicións controladas/óptimas, pero hai excepcións notables. Por exemplo, moitos morcegos e roedores son de tamaño similar, pero os morcegos viven moito máis tempo. Por exemplo, o morcego Myotis lucifugus, coa metade de tamaño que un rato, pode vivir 30 anos na natureza, mentres que un rato só vive de 2 a 3 anos en condicións óptimas. A explicación é que os morcegos teñen menos predadores e, por tanto, unha baixa mortalidade extrínseca. Hai máis individuos que sobreviven a idades maiores, polo que a forza da selección contra as mutacións deletéreas que actúan tardiamente é máis forte. Menos mutacións deletéreas que actúan tardiamente é igual a un envellecemento máis lento e, por tanto, unha duración da vida maior. As aves son tamén animais de sangue quente e son similares en tamaño a moitos pequenos mamíferos, pero viven de 5 a 10 veces máis. Teñen menos presión de depredación que os animais que viven no chan. As aves mariñas, as cales, en xeral, teñen o menor número de depredadores entre todas as aves son as que viven máis.
Cando se examinan os tamaños corporais fronte á duración da vida, pode observarse que os mamíferos depredadores tenden a vivir máis que os mamíferos presas nun ambiente controlado, como un zoo ou reserva natural. A explicación da longa duración das vidas dos primates (como humanos, monos e simios) en relación ao tamaño corporal é que a súa intelixencia e a miúdo a súa socialidade axúdanos a evitar converterse en presas. Unha alta posición na cadea alimenticia, a intelixencia e a cooperatividade reducen a mortalidade extrínseca nas especies.
Outra teoría evolutiva do envellecemento foi proposta por George C. Williams[40] e implica a pleiotropía antagonista. Un só xene pode afectar a múltiples trazos. Algúns trazos que incrementan a fitness nas etapas temperáns da vida poden tamén ter efectos negativos posteriormente na vida. Pero, como moitos máis individuos están vivos a idades novas que a idades vellas, mesmo pequenos efectos positivos na etapa temperá poden ser fortemente seleccionados a favor, e grandes efectos negativos tardíos poden ser moi debilmente seleccionados en contra. Williams suxeriu o seguinte exemplo: Quizais un xene codifica a deposición de calcio nos ósos, o cal promove a spervivencia xuvenil e será, por tanto, favorecido pola selección natural; porén, este mesmo xene promove a deposición de calcio nas arterias, causando efectos ateroscleróticos negativos en idades vellas. Así, os cambios bioloxicamente prexudiciais en idades vellas poden resultar a partir da selección de xenes pleiotrópicos que son beneficiosos en etapas temperás da vida pero prexudiciais posteriormente. Neste caso, a presión de selección é relativamente alta cando o valor reprodutivo de Fisher é alto, e relativamente baixa cando o valor reprodutivo de Fisher é baixo.
Regulación xénica
[editar | editar a fonte]- Véxase tamén: Xenética do envellecemento.
Identificáronse varios compoñentes xenéticos do envellecemento usando organismos modelo, desde os simples lévedos de xemación Saccharomyces cerevisiae a vermes como Caenorhabditis elegans e moscas Drosophila melanogaster. O estudo destes organismos revelou a presenza de polo menos dúas vías do envellecemento conservadas.
Nunha destas vías intervén o xene Sir2, unha histona desacetilase dependente de NAD+.[41] En lévedos, Sir2 é necesario para o silenciamento xenómico en tres loci: o locus de apareamento dos lévedos, os telómeros[42] e o ADN ribosómico (ADNr ou rDNA).[43] Nalgunhas especies de lévedos, o envellecemento replicaivo pode ser causado parcialmente por recombinación homóloga entre repeticións de ADNr; a escisión de repeticións de ADNr ten como resultado a formación de círculos de ADNr extracromosómicos (ERCs). Estes círculos replícanse e segregan preferentemente á célula nai durante a división celular, e crese que causan a senescencia celular por titrar (competir) factores nucleares esenciais. Os ERCs non se observaron noutras especies de lévedo (e nin sequera todas as cepas da mesma especie) que tamén mostran senescencia replicativa, e non se cre que os ERCs contribúan ao envellecemento en organismos superiores como os humanos, xa que non se observou que se acumulasen en mamíferos de maneira similar á dos lévedos).[44][45] O ADN circular extracromosómico (eccDNA) atopouse en vermes, moscas e humanos. A orixe e función do eccDNA no envellecemento, se a ten, non se coñece.[46]
Malia a falta de conexión entre o ADN circular e o envellecemento en organismos superiores, as copias extra de Sir2 poden ampliar a duración da vida de vermes e moscas (mais nas moscas, este descubrimento non foi repetido por outros investigadores, e o activador de Sir2 resveratrol non produce un incremento reproducible da vida nesas especies.[47]) Non está claro se os homólogos de Sir2 en organismos superiores teñen algún papel na duración da vida, pero demostrouse que a proteína SIRT1 humana desacetila p53, Ku70 e a familia de proteínas FOX de factores de transcrición. A SIRT1 pode tamén regular acetilatos como CBP/p300 e desacetila residuos de histonas específicas.[48][49]
RAS1 e RAS2 tamén afectan ao envellecemento dos lévedos e teñen un homólogo humano. A sobreexpresión de RAS2 aumenta a duración da vida en lévedos.[50]
Outros xenes regulan o envellecemento en lévedos ao incrementaren a resistencia ao estrés oxidativo. A superóxido dismutase, unha proteína que protexe contra os efectos dos radicais libres mitocondriais, pode aumentar a duración da vida dos lévedos en fase estacionaria cando se sobreexpresa.[51]
En organismos superiores, o envellecemento é probablemente regulado en parte por medio da vía insulina/IGF-1.[52] As mutacións que afectan a sinalización similar á insulina en vermes, moscas e o eixe hormona do crecemento/IGF-1 en ratos están asociados cun aumento da duración da vida. En lévedos, a actividade de Sir2 está regulada pola nicotinamidase PNC1.[53] A PNC1 é regulada á alza transcricionalmente en condicións de estrés como a restrición calórica, shock térmico e shock osmótico. Ao converter a nicotinamida en niacina, elimínase a nicotinamida, inhibindo a actividade de Sir2. Unha nicotinamidase atopada en humanos, chamada PBEF pode realizar unha función similar, e unha forma segregada de PBEF chamada visfatina pode axudar a regular os niveis séricos de insulina. Non se sabe se estes mecanismos existen tamén en humanos, xa que hai obvias diferenzas entre a bioloxía de humanos e a deses organismos modelo.[54]
A actividade de Sir2 increméntase baixo restrición calórica. Debido á falta de glicosa dispoñible nas células, hai máis NAD+ e pode así activarse Sir2. Informouse que o resveratrol, un estilbenoide atopado na pel das uvas tintas, aumenta a duración da vida en lévedos, vermes e moscas (pero en vermes e moscas non puido ser reproducido por outros investigadores[47]). Este activa Sir2 e, por tanto, imita os efectos da restrición calórica, se se acepta que a restrición calórica é verdadeiramente dependente de Sir2.
A expresión xénica está controlada imperfectamente, e é posible que as flutuacións nos niveis de expresión de moitos xenes contribúan ao proceso de envellecemento como suxire un estudo sobre eses xenes en lévedos.[55] As células, que son xeneticamente idénticas, poden malia todo ter respostas substancialmente diferentes a estímulos externos e duracións da vida marcadamente distintas, o que indica que os factores epixenéticos xogan un importante papel na expresión xénica e no envellecemento xunto a factores xenéticos.
Segundo a base de datos GenAge de xenes relacionados co envellecemento hai uns 700 xenes asociados co envellecemento en organismos modelo: 555 no verme nematodo Caenorhabditis elegans, 87 no lévedo de panadería Saccharomyces cerevisiae, 75 na mosca da froita Drosophila melanogaster e 68 no rato Mus musculus.[56] A seguinte lista mostra xenes que estaban asociados á lonxevidade en experimentos en organismos modelo:
| Podospora | Saccharomyces | Caenorhabditis | Drosophila | Mus |
|---|---|---|---|---|
| grisea | LAG1 | daf-2 | sod1 | Prop-1 |
| LAC1 | age-1/daf-23 | cat1 | p66shc (Non verificado independentemente) | |
| pit-1 | Ghr | |||
| RAS1 | daf-18 | mth | mclk1 | |
| RAS2 | akt-1/akt-2 | |||
| PHB1 | daf-16 | |||
| PHB2 | daf-12 | |||
| CDC7 | ctl-1 | |||
| BUD1 | old-1 | |||
| RTG2 | spe-26 | |||
| RPD3 | clk-1 | |||
| HDA1 | mev-1 | |||
| SIR2 | ||||
| aak-2 | ||||
| SIR4-42 | ||||
| UTH4 | ||||
| YGL023 | ||||
| SGS1 | ||||
| RAD52 | ||||
| FOB1 |
Danos químicos
[editar | editar a fonte]
Unha das primeiras teorías sobre o envellecemento foi a Hipótese da Taxa de Vida (Rate of Living Hypothesis) descrita por Raymond Pearl en 1928[57] (baseada en traballos anteriores de Max Rubner), que di que unha taxa metabólica basal rápida se corresponde cunha curta duración da vida máxima.
Aínda que a idea pode ter certa validez para varios tipos de danos específico detallados máis adiante que son subprodutos do metabolismo, a teoría de que, se as demais cousas son iguais, un metabolismo rápido pode reducir a duración da vida, en xeral non explica adecuadamente as diferenzas na duración da vida dentro dunha especie ou entre especies. A taxa metabólica é un mal preditor da duración da vida nas aves, morcegos e outras especies que se considera reduciron a mortalidade por predación, e, por tanto, evolucionaron para ter duracións da vida longas malia as súas altas taxas metabólicas.[58] Nunha análise feita en 2007 atopouse que, cando se empregan métodos estatísticos modernos para corrixir os efectos do tamaño corporal e a filoxenia, a taxa metabólica non se correlaciona coa lonxevidade en mamíferos ou aves.[59] (Para unha crítica da Rate of Living Hypothesis ver Living fast, dying when? (Vivir rápido, morrer cando?)[60])
Con respecto a tipos específicos de danos químicos causados polo metabolismo, suxeriuse que os danos a biopolímeros de longa vida, como as proteínas estruturais ou o ADN, causados por axentes químicos sempre presentes no corpo como o oxíxeno e os azucres, son en parte responsables do envellecemento. Os danos poden incluír a rotura das cadeas dos biopolímeros, os enlaces cruzados (reticulación) entre os biopolímeros ou a unión química de substituíntes non naturais (haptenos) aos biopolímeros.
En condicións aerobias normais, aproximadamente o 4% do oxíxeno metabolizado polas mitocondrias é convertido en ión superóxido, o cal seguidamente pode converterse en peróxido de hidróxeno, radical hidroxilo e finalmente outras especies reactivas como outros peróxidos e oxíxeno singulete, o cal pode, á súa vez, xerar radicais libres capaces de danar proteínas estruturais e o ADN. Certos ións metálicos que se encontran no corpo, como o cobre e o ferro, poden participar no proceso. (Na enfermidade de Wilson, un trastorno xenético que causa que o corpo reteña o cobre, algúns dos síntomas lembran os da senescencia acelerada.) Estes procesos denominados estrés oxidativo están ligados aos beneficios potenciais dos antioxidantes polifenois da dieta, por exemplo os do café,[61] viño tinto e té.[62]
Os azucres como a glicosa e a frutosa poden reaccionar con certos aminoácidos como a lisina e arxinina e certas bases do ADN como a guanina producindo adutos azucres, nun proceso chamado glicación. Estes adutos poden despois modificarse para formar especies reactivas, as cales poden despois establecer enlaces cruzados entre proteínas estruturais ou o ADN e outros biopolímeros similares ou outras biomoléculas, como as proteínas non estruturais. As persoas con diabetes, que teñen un nivel de azucre no sangue elevado, desenvolven trastornos asociados á senescencia moito antes que a poboación xeral, pero poden atrasar a aparición de tales desordes mediante un rigoroso control dos niveis de azucre sanguíneos. Hai evidencias de que os danos polo azucre están ligados aos danos oxidantes nun proceso denominado glicoxidación.
Os radicais libres poden danar as proteínas, lípidos ou ADN. A glicación dana principalmente as proteínas. As proteínas e lípidos danados acumúlanse en lisosomas como lipofuscina. Os danos químicos en proteínas estruturais poden orixinar a perda de función; por exemplo, danos ao coláxeno das paredes dos vasos sanguíneos poden causar o endurecemento da parede dos vasos e, así, a hipertensión arterial, e o engrosamento da parede dos vasos sanguíneos e a formación de tecidos reactivos (aterosclerose); procesos similares nos riles poden orixinar insuficiencia renal. Os danos que afectan aos encimas reducen a funcionalidade celular. A peroxidación dos lípidos da membrana mitocondrial interna reduce o potencial eléctrico e a capacidade de xerar enerxía. Probablemente non é casual que case todas as denominadas "enfermidades de envellecemento acelerado" se deban a defectos en encimas de reparación do ADN.
Pénsase que o impacto de alcohol sobre o envellecemento pode en parte explicarse pola activación polo alcohol do eixe hipotalámico-hipofisario-adrenal, o cal estimula a secreción de glicocorticoides, e a exposición a longo prazo a eles produce síntomas de envellecemento.[63]
Teoría do envellecemento por danos no ADN
[editar | editar a fonte]P. Alexander[64] foi o primeiro que propuxo que os danos no ADN son a causa principal do envellecemento. As primeiras evidencias experimentais que apoiaron esta idea foron revisadas por Gensler e Bernstein.[65] A inicios da década de 1990 o apoio experimental para esta proposta era substancial, e posteriormente indicouse que os danos no ADN debidos a especies reactivas no oxíxeno eran a fonte maior dos danos no ADN que causaban o envellecemento.[66][67][68][69][70] O estado da cuestión en canto a esta teoría foi revisado na teoría do envellecemento por danos no ADN de Bernstein et al.[71]
Teoría da fiabilidade
[editar | editar a fonte]- Artigo principal: Teoría da fiabilidade do envellecemento e a lonxevidade.
A teoría da fiabilidade suxire que os sistemas biolóxicos empezan a súa vida adulta cunha gran carga inicial de danos. A teoría da fiabilidade é unha teoría xeral sobre fallos nos sistemas. Permite aos investigadores predicir a cinética dos fallos relacionados coa idade para un sistema cunha determinada arquitectura (estrutura de fiabilidade) e unha determinada fiabilidade dos compoñentes. A teoría da fiabilidade predí que mesmo aqueles sistemas que están compostos enteiramente de elementos non relacionados co envellecemento (cunha taxa de fallos constante) vanse deteriorar a pesar de todo (fallarán máis a miúdo) co paso do tempo (idade), se estes sistemas son redundantes en elementos insubstituíbles. O envellecemento, por tanto, é unha consecuencia directa dos sistemas.
A teoría da fiabilidade tamén predí a deceleración da mortalidade na vida tardía cunha subseguinte nivelación, e tamén a meseta de mortalidade na vida tardía, como unha consecuencia inevitable do esgotamento da redundancia en idades vellas extremas. A teoría explica por que as taxas de mortalidade se incrementan expeonencialmente coa idade (a lei de Gompertz) en moitas especies, ao ter en conta os fallos iniciais (defectos) en sistemas de nova formación. Tamén explica por que os organismos "prefiren" morrer seguindo a lei de Gompertz, mentres que os aparellos técnicos usualmente fallan seguindo a lei de Weibull. A teoría da fiabilidade permite especificar as condicións cando os organismos morren de acordo á distribución de Weibull: os organismos deberían carecer relativamente de fallos e defectos iniciais. A teoría fai posible encontrar unha lei de fallos xeral aplicable a todos os adultos e anciáns de avanzada idade, nos que as leis de Gompertz e Weibull son simplemente casos especiais dunha lei de fallos máis xeral. A teoría explica por que as diferenzas relativas nas taxas de mortalidade de poboacións comparadas (nunha especie determianda) se esvaen coa idade (compensación da lei da mortalidade), e explica a converxencia da mortalidade que se observasdebido ao esgotamento das diferenzas iniciais en niveis de redundancia.
Miscelánea
[editar | editar a fonte]Os reloxos biolóxicos, que miden obxectivamente a idade biolóxica de células e tecidos, poden ser útiles para comprobar diferentes teorías do envellecemento biolóxico.[14]
Coñécense un conxunto de raros trastornos hereditarios (xenéticos), chamados proxerias. Os pacientes mostran síntomas que semellan un envellecemento acelerado, entre os que está o engurramento da pel. A causa da síndrome de proxeria de Hutchinson–Gilford publicouse na revista Nature en 2003.[72] Nese informe suxírese que os danos no ADN, e non o estrés oxidativo, son a causa desta forma de envellecemento acelerado.
Recentemente, alegouse que un tipo de senescencia temperá é un posible resultado accidental que aparece nalgúns dos primeiros experimentos de clonación, como o caso da clonación da ovella Dolly. Porén, a afirmación de que na morte de Dolly estivo implicada a senescencia prematura foi moi discutido,[73] e o creador de Dolly, Dr. Ian Wilmut, expresou que a enfermidade e morte da ovella seguramente non estaba relacionada co feito de que fose un clon.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Ainsworth, C; Lepage, M (2007). "Evolution's greatest mistakes". New Scientist 195 (2616): 36–39. doi:10.1016/S0262-4079(07)62033-8.
- ↑ Walker, R.; Pakula, L.; Sutcliffe, M.; Kruk, P.; Graakjaer, J.; Shay, J. (2009). "A case study of "disorganized development" and its possible relevance to genetic determinants of aging". Mechanisms of ageing and development 130 (5): 350–356. PMID 19428454. doi:10.1016/j.mad.2009.02.003.
- ↑ Brown, Bob (23 de xuño de 2006). "Doctors Baffled, Intrigued by Girl Who Doesn't Age". Health (ABC News). Consultado o 27 de xuño de 2009.
- ↑ Aubrey D.N.J, de Grey (2007). "Life Span Extension Research and Public Debate: Societal Considerations" (PDF). Studies in Ethics, Law, and Technology 1 (1). doi:10.2202/1941-6008.1011. Article 5. Arquivado dende o orixinal (PDF) o 13 de outubro de 2016. Consultado o 30 de outubro de 2016.
- ↑ "SENS Foundation".
- ↑ Hayflick L; Moorhead PS (decembro de 1961). "The serial cultivation of human diploid cell strains". Exp. Cell Res. 25: 585–621. PMID 13905658. doi:10.1016/0014-4827(61)90192-6.
- ↑ Campisi, Judith (febreiro de 2013). "Aging, Cellular Senescence, and Cancer". Annual Review of Physiology 75: 685–705. PMC 4166529. PMID 23140366. doi:10.1146/annurev-physiol-030212-183653.
- ↑ Rodier, F.; Campisi, J. (14 de febreiro de 2011). "Four faces of cellular senescence". The Journal of Cell Biology 192 (4): 547–556. doi:10.1083/jcb.201009094.
- ↑ Burton, Dominick G. A.; Krizhanovsky, Valery (31 de xullo de 2014). "Physiological and pathological consequences of cellular senescence". Cellular and Molecular Life Sciences 71 (22): 4373–4386. doi:10.1007/s00018-014-1691-3.
- ↑ 10,0 10,1 10,2 Baker, D.; Wijshake, T.; Tchkonia, T.; LeBrasseur, N.; Childs, B.; van de Sluis, B.; Kirkland, J.; van Deursen, J. (10 de novembro de 2011). "Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders". Nature 479: 232–6. PMC 3468323. PMID 22048312. doi:10.1038/nature10600.
- ↑ Xu, M; Palmer, AK; Ding, H; Weivoda, MM; Pirtskhalava, T; White, TA; Sepe, A; Johnson, KO; Stout, MB; Giorgadze, N; Jensen, MD; LeBrasseur, NK; Tchkonia, T; Kirkland, JL (2015). "Targeting senescent cells enhances adipogenesis and metabolic function in old age". eLife 4. PMC 4758946. PMID 26687007. doi:10.7554/eLife.12997.
- ↑ Quick, Darren (3 de febreiro de 2016). "Clearing out damaged cells in mice extends lifespan by up to 35 percent". www.gizmag.com. Consultado o 2016-02-04.
- ↑ Regalado, Antonio (3 de febreiro de 2016). "In New Anti-Aging Strategy, Clearing Out Old Cells Increases Life Span of Mice by 25 Percent". MIT Technology Review. Consultado o 2016-02-04.
- ↑ 14,0 14,1 Horvath S (2013). "DNA methylation age of human tissues and cell types". Genome Biology 14: R115. PMC 4015143. PMID 24138928. doi:10.1186/gb-2013-14-10-r115. Arquivado dende o orixinal o 20 de xaneiro de 2018. Consultado o 30 de outubro de 2016.
- ↑ 15,0 15,1 15,2 Lowe, D (2016). "Epigenetic clock analyses of cellular senescence and ageing.". Oncotarget 7 (8): 8524–8531. PMID 26885756. doi:10.18632/oncotarget.7383. Arquivado dende o orixinal o 22 de outubro de 2016. Consultado o 30 de outubro de 2016.
- ↑ Gavrilov LA; Gavrilova NS (decembro de 2001). "The reliability theory of aging and longevity". Journal of Theoretical Biology 213 (4): 527–45. PMID 11742523. doi:10.1006/jtbi.2001.2430.
- ↑ Stephens C (abril de 2005). "Senescence: even bacteria get old". Curr. Biol. 15 (8): R308–10. PMID 15854899. doi:10.1016/j.cub.2005.04.006.
- ↑ Burton; Faragher (2015). "Cellular senescence: from growth arrest to immunogenic conversion". AGE 37. doi:10.1007/s11357-015-9764-2.
- ↑ Collins FS, et al. (13 de xuño de 2011). "Progerin and telomere dysfunction collaborate to trigger cellular senescence in normal human fibroblasts". J Clin Invest. 121 (7): 2833–44. PMC 3223819. PMID 21670498. doi:10.1172/JCI43578.
- ↑ Hanahan D; Weinberg RA (xaneiro de 2000). "The hallmarks of cancer". Cell 100 (1): 57–70. PMID 10647931. doi:10.1016/S0092-8674(00)81683-9.
- ↑ Krishnamurthy, J; Torrice, C; Ramsey, MR; Kovalev, GI; Al-Regaiey, K; Su, L; Sharpless, NE (2004). "Ink4a/Arf expression is a biomarker of aging". J. Clin. Invest. 114 (9): 1299–1307. PMC 524230. PMID 15520862. doi:10.1172/JCI22475.
- ↑ Baker DJ; Dawlaty MM; Wijshake T; Jeganathan KB; Malureanu L; van Ree JH; Crespo-Diaz R; Reyes S; Seaburg L; Shapiro V; Behfar A; Terzic A; van de Sluis B; van Deursen JM (Jan 2013). "Increased expression of BubR1 protects against aneuploidy and cancer and extends healthy lifespan". Nat Cell Biol 15 (1): 96–102. PMID 23242215. doi:10.1038/ncb2643.
- ↑ Zhu, Y; Tchkonia, T; Pirtskhalava, T; Gower, AC; Ding, H; Giorgadze, N; Palmer, AK; Ikeno, Y; Hubbard, GB; Lenburg, M; O'Hara, SP; LaRusso, NF; Miller, JD; Roos, CM; Verzosa, GC; LeBrasseur, NK; Wren, JD; Farr, JN; Khosla, S; Stout, MB; McGowan, SJ; Fuhrmann-Stroissnigg, H; Gurkar, AU; Zhao, J; Colangelo, D; Dorronsoro, A; Ling, YY; Barghouthy, AS; Navarro, DC; Sano, T; Robbins, PD; Niedernhofer, LJ; Kirkland, JL (9 de marzo de 2015). "The Achilles' heel of senescent cells: from transcriptome to senolytic drugs.". Aging Cell 14: 644–58. PMID 25754370. doi:10.1111/acel.12344.
- ↑ "Aging and Gerontology Glossary". Consultado o 26 de febreiro de 2011.
- ↑ Austad, S (2009). "Comparative Biology of Aging". J Gerontol a Biol Sci Med Sci 64 (2): 199–201. PMC 2655036. PMID 19223603. doi:10.1093/gerona/gln060.
- ↑ Williams, G.C. (1957). "Pleiotropy, natural selection, and the evolution of senescence". Evolution 11: 398–411. doi:10.2307/2406060.
- ↑ Emmanuel EJ. "Why I hope to die at 75: An argument that society and families – and you – will be better off if nature takes its course swiftly and promptly". The Atlantic. Consultado o 7 de abril de 2015.
- ↑ Faria MA. "Bioethics and why I hope to live beyond age 75 attaining wisdom!: A rebuttal to Dr. Ezekiel Emanuel′s 75 age limit.". Surg Neurol Int 2015;6:35. Consultado o 7 de abriol de 2015.
- ↑ Faria MA. "Longevity and compression of morbidity from a neuroscience perspective: Do we have a duty to die by a certain age?". Surg Neurol Int 2015;6:49. Consultado o 7 de abril de 2015.
- ↑ Thomas C. J. Tan; Ruman Rahman; Farah Jaber-Hijazi; Daniel A. Felix; Chen Chen; Edward J. Louis & Aziz Aboobaker (febreiro de 2012). "Telomere maintenance and telomerase activity are differentially regulated in asexual and sexual worms" (PDF). PNAS 109 (9): 4209–4214. doi:10.1073/pnas.1118885109.
- ↑ Bowen RL; Atwood CS (2011). "The reproductive-cell cycle theory of aging: an update.". Experimental Gerontology 46 (2): 100–7. PMID 20851172. doi:10.1016/j.exger.2010.09.007.
- ↑ Lopez-Otin, C; et al. (2013). "The hallmarks of aging.". Cell 153: 1194–217. PMC 3836174. PMID 23746838. doi:10.1016/j.cell.2013.05.039.
- ↑ Medawar, P.B. (1952). An Unsolved problem of biology; an inaugural lecture delivered at University College, London, 6 de decembro de 1951. Londres: H.K. Lewis. OCLC 8482093.
- ↑ Williams, G.C. (1957). "Pleiotropy, Natural Selection, and the Evolution of Senescence". Evolution 11: 398–411. doi:10.2307/2406060.
- ↑ Hamilton WD (setembro de 1966). "The moulding of senescence by natural selection". J. Theor. Biol. 12 (1): 12–45. PMID 6015424. doi:10.1016/0022-5193(66)90184-6.
- ↑ Kirkwood TB (novembro de 1977). "Evolution of ageing". Nature 270 (5635): 301–4. PMID 593350. doi:10.1038/270301a0.
- ↑ Fabian, Daniel; Flatt, Thomas (2011). "The Evolution of Aging". Scitable. Nature Publishing Group. Consultado o 9 de decembro de 2014.
- ↑ Medawar PB (1946). "Old age and natural death". Modern Quarterly 1: 30–56.
- ↑ Medawar, Peter B. (1952). An Unsolved Problem of Biology. Londres: H. K. Lewis.
- ↑ Williams, George C. (decembro de 1957). "Pleiotropy, Natural Selection, and the Evolution of Senescence". Evolution 11 (4): 398–411. JSTOR 2406060. doi:10.2307/2406060.
- ↑ Ha CW, Huh WK. The implication of Sir2 in replicative aging and senescence in Saccharomyces cerevisiae. Aging (Albany NY). 2011 Mar;3(3):319-24. PMID 21415463. PMCID 3091525. DOI 10.18632/aging.100299
- ↑ Immanual Joseph. Telomere Recombination in Senescence Bypass and Meiosis of Saccharomyces cerevisiae. Google books. Páxinas 14-15 [1] Arquivado 04 de novembro de 2016 en Wayback Machine.
- ↑ Kimiko Saka, Satoru Ide, Austen R.D. Ganley, Takehiko Kobayashi. Cellular Senescence in Yeast Is Regulated by rDNA Noncoding Transcription. Current Biology. Volume 23, Issue 18, 23 de setembro de 2013, Pages 1794–1798. [2]
- ↑ Valter D. Longo, Gerald S. Shade, Matt Kaeberlein, Brian Kennedy. Replicative and Chronological Aging in Saccharomyces cerevisiae. Cell Metabolism. Volume 16, Issue 1, 3 de xullo de 2012, Pages 18–31. [3]
- ↑ Matt Kaeberlein, Mitch McVey, and Leonard Guarente. The SIR2/3/4 complex and SIR2 alone promote longevity in Saccharomyces cerevisiae by two different mechanisms. Genes Dev. 1999 Oct 1; 13(19): 2570–2580. PMCID: PMC317077. [4]
- ↑ N van Loon, D Miller, and J P Murnane. Formation of extrachromosomal circular DNA in HeLa cells by nonhomologous recombination. Nucleic Acids Res. 1994 Jul 11; 22(13): 2447–2452. PMCID: PMC308194 [5]
- ↑ 47,0 47,1 Bass TM; Weinkove D; Houthoofd K; Gems D; Partridge L (outubro de 2007). "Effects of resveratrol on lifespan in Drosophila melanogaster and Caenorhabditis elegans". Mechanisms of Ageing and Development 128 (10): 546–52. PMID 17875315. doi:10.1016/j.mad.2007.07.007.
- ↑ Salvatore Fusco, Giuseppe Maulucci e Giovambattista Pani. Sirt1. Def-eating senescence? Cell Cycle. 2012 Nov 15; 11(22): 4135–4146. doi 10.4161/cc.22074. PMCID: PMC3524209. [6]
- ↑ Christopher L. Brooks & Wei Gu. How does SIRT1 affect metabolism, senescence and cancer? Nature Reviews Cancer 9, 123-128 (febreiro de 2009). doi:10.1038/nrc2562. [7]
- ↑ J Sun, S P Kale, A M Childress, C Pinswasdi and S M Jazwinski. Divergent roles of RAS1 and RAS2 in yeast longevity. The Journal of Biological Chemistry. 269, 18638-18645. 15 de xullo de 1994. [8]
- ↑ Barker MG1, Brimage LJ, Smart KA. Effect of Cu,Zn superoxide dismutase disruption mutation on replicative senescence in Saccharomyces cerevisiae. FEMS Microbiol Lett. 1999 Aug 15;177(2):199-204. PMID 10474184.
- ↑ Tran D, Bergholz J, Zhang H, He H, Wang Y, Zhang Y, Li Q, Kirkland JL, Xiao ZX. Insulin-like growth factor-1 regulates the SIRT1-p53 pathway in cellular senescence. Aging Cell. 2014 Aug;13(4):669-78. doi: 10.1111/acel.12219. Epub 2014 Apr 30. PMID 25070626. PMCID: PMC4118446. DOI: 10.1111/acel.12219
- ↑ GenDR Dietary Restriction Gene Manipulation: PNC1. Gene Information (Entrez Gene ID: 852846) [9]
- ↑ Eric van der Veer, Cynthia Ho, Caroline O'Neil, Nicole Barbosa, Robert Scott, Sean P. Cregan and J. Geoffrey Pickering. Extension of Human Cell Lifespan by Nicotinamide Phosphoribosyltransferase. The Journal of Biological Chemistry. 282, 10841-10845. [10]
- ↑ Ryley J; Pereira-Smith OM (2006). "Microfluidics device for single cell gene expression analysis in Saccharomyces cerevisiae". Yeast 23 (14–15): 1065–73. PMID 17083143. doi:10.1002/yea.1412.
- ↑ "GenAge database". Consultado o 26 de febreiro de 2011.
- ↑ Pearl, Raymond (1928). The Rate of Living, Being an Account of Some Experimental Studies on the Biology of Life Duration. New York: Alfred A. Knopf.[cómpre nº de páxina]
- ↑ Brunet-Rossinni AK; Austad SN (2004). "Ageing studies on bats: a review". Biogerontology 5 (4): 211–22. PMID 15314271. doi:10.1023/B:BGEN.0000038022.65024.d8.
- ↑ de Magalhães JP; Costa J; Church GM (1 de febreiro de 2007). "An Analysis of the Relationship Between Metabolism, Developmental Schedules, and Longevity Using Phylogenetic Independent Contrasts". The Journals of Gerontology Series A: Biological Sciences and Medical Sciences 62 (2): 149–60. PMC 2288695. PMID 17339640. doi:10.1093/gerona/62.2.149. Arquivado dende o orixinal o 23 de decembro de 2014. Consultado o 30 de outubro de 2016.
- ↑ Speakman JR; Selman C; McLaren JS; Harper EJ (1 de xuño de 2002). "Living fast, dying when? The link between aging and energetics". The Journal of Nutrition 132 (6 Suppl 2): 1583S–97S. PMID 12042467.
- ↑ Freedman ND; Park Y; Abnet CC; Hollenbeck AR; Sinha R (maio de 2012). "Association of coffee drinking with total and cause-specific mortality". N. Engl. J. Med. 366 (20): 1891–904. PMC 3439152. PMID 22591295. doi:10.1056/NEJMoa1112010.
- ↑ Yang Y; Chan SW; Hu M; Walden R; Tomlinson B (2011). "Effects of some common food constituents on cardiovascular disease". ISRN Cardiol 2011: 397136. PMC 3262529. PMID 22347642. doi:10.5402/2011/397136.
- ↑ Spencer RL; Hutchison KE (1999). "Alcohol, aging, and the stress response" (PDF). Alcohol Research & Health 23 (4): 272–83. PMID 10890824. Arquivado dende o orixinal (PDF) o 11 de decembro de 2018. Consultado o 30 de outubro de 2016.
- ↑ Alexander P (1967). "The role of DNA lesions in the processes leading to aging in mice". Symp. Soc. Exp. Biol. 21: 29–50. PMID 4860956.
- ↑ Gensler HL; Bernstein H (setembro de 1981). "DNA damage as the primary cause of aging". Q Rev Biol 56 (3): 279–303. PMID 7031747. doi:10.1086/412317.
- ↑ Bernstein C; Bernstein H (1991). Aging, Sex, and DNA Repair. San Diego CA: Academic Press. ISBN 0123960037.
- ↑ Ames BN; Gold LS (1991). "Endogenous mutagens and the causes of aging and cancer". Mutat. Res. 250 (1-2): 3–16. PMID 1944345. doi:10.1016/0027-5107(91)90157-j.
- ↑ Holmes GE; Bernstein C; Bernstein H (setembro de 1992). "Oxidative and other DNA damages as the basis of aging: a review". Mutat. Res. 275 (3-6): 305–15. PMID 1383772. doi:10.1016/0921-8734(92)90034-M.
- ↑ Rao KS; Loeb LA (setembro de 1992). "DNA damage and repair in brain: relationship to aging". Mutat. Res. 275 (3-6): 317–29. PMID 1383773. doi:10.1016/0921-8734(92)90035-N.
- ↑ Ames BN; Shigenaga MK; Hagen TM (setembro de 1993). "Oxidants, antioxidants, and the degenerative diseases of aging". Proc. Natl. Acad. Sci. U.S.A. 90 (17): 7915–22. PMC 47258. PMID 8367443. doi:10.1073/pnas.90.17.7915.
- ↑ Bernstein, H; Payne, CM; Bernstein, C; Garewal, H; Dvorak, K (2008). "Cancer and aging as consequences of un-repaired DNA damage.". En Kimura, Honoka; Suzuki, Aoi. New Research on DNA Damage. Nova Science Publishers. pp. 1–47. ISBN 978-1604565812.
- ↑ Mounkes LC; Kozlov S (2003). "A progeroid syndrome in mice is caused by defects in A-type lamins" (PDF). Nature 423 (6937): 298–301. doi:10.1038/nature01631.
- ↑ Macintosh, Kerry Lynn (2005). Illegal Beings: Human Clones and the Law. Cambridge: Cambridge University Press. ISBN 0-521-85328-1.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Proxeria
- Envellecemento humano
- Cerebro envellecido
- Doenzas asociadas ao envellecemento
- Teoría do envellecemento por danos no ADN
- Reparación do ADN
- Radical libre
- Inmortalidade
- Estrés oxidativo
- Senescencia das plantas
- Morte celular programada
- Medicina rexenerativa
- Teoría do envellecemento das células nai
Ligazóns externas
[editar | editar a fonte]- Senescence.info
- Loita contra o envellecemento!
- Fundación SENS
- AgeLab (Instituto de Tecnoloxía de Massachusetts)
- Envellecemento celular Arquivado 21 de maio de 2008 en Wayback Machine.
- Acurtamento dos telómeros Arquivado 30 de outubro de 2016 en Wayback Machine.
- Jones, Owen R.; Scheuerlein, Alexander; Salguero-Gómez, Roberto; Camarda, Carlo Giovanni; Schaible, Ralf; Casper, Brenda B.; Dahlgren, Johan P.; Ehrlén, Johan; García, María B.; Menges, Eric S.; Quintana-Ascencio, Pedro F.; Caswell, Hal; Baudisch, Annette; Vaupel, James W. (2013). "Diversity of ageing across the tree of life". Nature 505: 169–173. doi:10.1038/nature12789. Resumo divulgativo – National Geographic (8 decembro 2013).
