Sistema cinina-calicreína
O sistema cinina-calicreína ou simplemente sistema da cinina é un sistema hormonal mal coñecido con pouca investigación dispoñible.[1] Consta de proteínas sanguíneas que xogan un papel na inflamación,[2] control da presión arterial, coagulación do sangue e dor. Os seus importantes mediadores bradicinina e calidina son vasodilatadores e actúan sobre moitos tipos celulares.
Historia
[editar | editar a fonte]O sistema foi descuberto en 1909 cando se atopou que unha inxección de urina (con alta concentración de cininas) orixinaba hipotensión.[3] Os investigadores Emil Karl Frey, Heinrich Kraut e Eugen Werle descubriron o cininóxeno de alto peso molecular na urina no ano 1930.[4]
Etimoloxía
[editar | editar a fonte]Cinina vén do grego kīn(eîn), 'moverse, poñer en movemento'. Calicreína vén do grego kalli '~doce' e krein, de kreos, 'carne', nomeada polos extractos pancreáticos onde se descubriu.
Compoñentes do sistema cinina-calicreína
[editar | editar a fonte]O sistema componse dunha serie de proteínas grandes, algúns pequenos polipéptidos e un grupo de encimas que activan e desactivan as substancias.
Polipéptidos (cininas)
[editar | editar a fonte]Son a bradicinina e a calidina.
A bradicinina (BK, bradykinin) actúa sobre o receptor B2 e tamén lixeiramente sobre o receptor B1,[5] e orixínase cando a calicreína o libera do cininóxeno de alto peso molecular. É un nonapéptido cuxa secuencia de aminoácidos é Arg–Pro–Pro–Gly–Phe–Ser–Pro–Phe–Arg.
A calidina (KD, kallidin) é un decapéptido, e prodúcese cando a calicreína o libera do cininóxeno de baixo peso molecular. Ten a mesma secuencia de aminoácidos que a bradicinina coa adición dunha lisina no seu N-terminal, polo que ás veces se denomina Lys-bradicinina ou lisilbradicinina.
Proteínas (cininóxenos)
[editar | editar a fonte]Son o cininóxeno de alto peso molecular (HMWK) e o cininóxeno de baixo peso molecular (LMWK), que son precursores dos polipéptidos.
O cininóxeno de alto peso molecular fórmase no fígado xunto coa precalicreína, actúa principalmente como un cofactor para a coagulación e a inflamación e non ten actividade catalítica intrínseca.
O cininóxeno de baixo peso molecular fórmase localmente en numerosos tecidos e segrégase xunto coa calicreína dos tecidos.
O HMWK e o LMWK fórmanse por empalme alternativo do mesmo xene.[6]
Encimas
[editar | editar a fonte]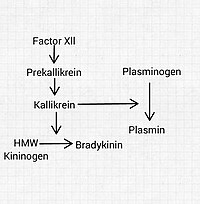
Os encimas que interveñen neste sistema actuando sobre as cininas son:
- Calicreínas plasmática e dos tecidos, que son serina proteases encargadas de liberar as cininas dos cininóxenos. As calicreínas (calicreina plasmática e tisular) son serina proteases que liberan cininas[7] (bradicinina e calidina) a partir dos cininóxenos, que son proteínas plasmáticas que son convertidas en péptidos vasoactivos.[8] A precalicreína é o precursor da calicreína plasmática. Só pode activar as cininas despois de ser ela activada polo factor XIIa ou outros estímulos.
- Carboxipeptidases, presentes en dúas formas: N, circulante e M, unida a membranas. Eliminan os residuos de arxinina do extremo carboxilo terminal da bradicinina e a calidina.
- Encima convertedor de anxiotensina (ACE), tamén chamado quinase II, que inactiva varios mediadores químicos, incluído a bradicinina, aínda que é mellor coñecida por activar a anxiotensina.
- Endopeptidase neutra, que tamén desactiva cininas e outros mediadores.
Farmacoloxía
[editar | editar a fonte]A inhibición do encima convertedor da anxiotensina (ACE) cos inibidores de ACE orixina un descenso na conversión da anxiotensina I a anxiotensina II (un vasoconstritor) pero ademais un incremento na bradicinina debido a unha diminución da súa degradación. Isto explica por que algúns pacientes que están tomando inhibidores de ACE desenvolven unha tose seca, e algúns reaccionan cun anxioedema, un perigoso inchamento da rexión do pescozo e cabeza.
Presentáronse hipóteses que sinalan que moitos dos efectos beneficiosos dos inhibidores de ACE débense á súa influencia sobre o sistema cinina-calicreina. Isto inclúe os seus efectos en hipertensión arterial, na remodelación ventricular (despois dun infarto de miocardio) e posiblemente nefropatía diabética.
Papel en enfermidades
[editar | editar a fonte]Os defectos do sistema cinina-calicreína en enfermidades non son xeralmente recoñecidos. O sistema está sendo moi investigado debido ás súas relacións cos sistemas da inflamación e presión arterial. Sábese que as cininas son mediadores inflamatorios que causan a dilatación dos vasos sanguíneos e un incremento da permeabilidade vascular. As cininas son pequenos péptidos producidos a partir do cininóxeno pola calicreina e son degradados por cininases. Actúan sobre fosfolipases e incrementan a liberación de ácido araquidónico e dese modo a produción de prostaglandinaa (PGE2).
Implicación de C1-INH
[editar | editar a fonte]O inhibidor de C1 (c1-INH) é unha proteína inhibidora da serina protease (serpina). O C1-INH é o inhibidor fisiolóxico máis importante da calicreína plasmática, fXIa e fXIIa. O C1-INH tamén inhibe proteinases das vías fibrinolítica, coagulante e da cinina. A deficiencia de C1-INH permite a activación da calicreína do plasma, que orixina a produción do péptido vasoactivo bradicinina.
Notas
[editar | editar a fonte]- ↑ Seth (1 January 2008). Textbook Of Pharmacology. Elsevier India. pp. 603–. ISBN 978-81-312-1158-8. Consultado o 25 November 2010.
- ↑ Duchene (2011). "Kallikrein-kinin kystem in inflammatory diseases". Kinins. De Gruyter. pp. 261–272. ISBN 978-3-11-025235-4.
- ↑ Abelous JE, Bardier E (1909). "Les substances hypotensives de l'urine humaine normale". CR Soc Biol (en French) 66: 511–20.
- ↑ Kraut H, Frey EK, Werle E (1930). "Der Nachweis eines Kreislaufhormon in der Pankreasdrüse". Hoppe-Seyler's Z Physiol Chem 189 (3–4): 97–106. doi:10.1515/bchm2.1930.189.3-4.97. Arquivado dende o orixinal o 28 de xuño de 2018. Consultado o 27 de marzo de 2019. (require subscrición (?)).
- ↑ Walker, Katharine; Perkins, Martin; Dray, Andy (1995-1). "Kinins and kinin receptors in the nervous system". Neurochemistry International (en inglés) 26 (1): 1–16. doi:10.1016/0197-0186(94)00114-A.
- ↑ Goodman & Gilman's Pharmacology; Chapter 24. Histamine, Bradykinin, and Their Antagonists
- ↑ Stefan Offermanns; Walter Rosenthal (2008). Encyclopedia of Molecular Pharmacology. Springer. pp. 673–. ISBN 978-3-540-38916-3. Consultado o 11 December 2010.
- ↑ Kumar, V., Abbas, A., Fausto, N. (Editors) Robbins and Cotran pathologic basis of disease. 7th ed. Philadelphia: Elsevier 2005;Page 65.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Kallikrein-Kinin System Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
