Amplificador xenético
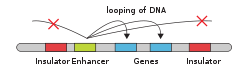
En xenética, un amplificador xenético, potenciador xenético ou enhancer é unha curta rexión de ADN á que se poden unir certas proteínas para amplificar ou potenciar os niveis de transcrición dun xene nun cluster de xenes. As proteínas que se unen aos amplificadores son factores que actúan en trans como un conxunto de factores de transcrición. Os amplificadores ou enhancers xeralmente actúan en cis, e un amplificador non ten por que estar moi preto dos xenes sobre os que actúa, e mesmo en certos casos non está situado no mesmo cromosoma.[1]
Localización dos amplificadores
[editar | editar a fonte]Nas células eucariotas a estrutura do complexo cromatínico do ADN está pregada de modo que imita funcionalmente o estado superenrolado característico do ADN procariótico, de maneira que, aínda que o ADN do amplificador está lonxe do xene sobre o que actúa en canto ao número de nucleótidos que os separan, xeometricamente está situado preto do promotor e o xene. Isto permite que interaccione cos factores de transcrición xeral e a ARN polimerase II. O mesmo mecanismo funciona para os silenciadores do xenoma eucariótico. Os silenciadores son antagonistas dos amplificadores e, cando se unen aos seus propios factores de transcrición, chamados represores, reprimen a transcrición do xene. Os silenciadores e os amplificadores poden estar en estreita proximidade uns dos outros ou mesmo poden ser a mesma rexión de ADN que funciona de xeito diferente segundo o factor de transcrición que se una e a ela.
Un amplificador pode estar localizado augas arriba ou abaixo do xene que regula. Ademais, un amplificador non ten que estar situado preto do sitio de iniciación da transcrición para afectar á transcrición, xa que algúns están localizados a varios centos de miles de pares de bases augas arriba ou abaixo do sitio de iniciación. Os amplificadores non actúan sobre a propia rexión promotora, senón que se unen por medio de proteínas chamadas activadores. Estas proteínas activadoras interaccionan co complexo mediador, que recruta a ARN polimerase II e os factores de transcrición xerais, que despois empezan a transcribir os xenes. Os amplificadores poden tamén encontrarse en intróns. A orientación dun amplificador pode ás veces ser invertida sen que iso afecte á súa función. Ademais, un amplificador pode ser escindido e inserido en calquera outro sitio do cromosoma, e segue afectando á transcrición do xene. Esa é unha das razóns polas que os polimorfismos en intróns poden ter efectos a pesar de que non son elementos que se traduzan a proteínas.
Teorías
[editar | editar a fonte]Actualmente, hai dúas teorías sobre como se procesa a información nos amplificadores na expresión xénica, que considera que poderían actuar seguindo dous posibles modelos, que son:[2]
- Amplificadores de tipo enhanceosoma (~amplificosoma). O seu funcionamento depende dunha acción moi coordinada e cooperativa e poden ser inutilizados por unha soa mutación puntual que move ou elimina os sitios de unión de determinadas proteínas. Os enhanceosomas son complexos proteicos que se forman sobre o xene, regulándoo.[2]
- Amplificadores de tipo "cartel" (billboard). Teñen unha forma de ler a información que actúa de forma menos integradora pero máis flexible. Moitas proteínas regulan independentemente a expresión xénica e a súa suma debe ser lida pola maquinaria de transcrición para producir o efecto.[2]
Exemplos no xenoma humano
[editar | editar a fonte]HACNS1
[editar | editar a fonte]O HACNS1 (tamén chamado CENTG2 e localizado na Rexión Acelerada Humana 2 é un amplificador xénico "que puido ter contribuído á evolución do polegar opoñible humano, e posiblemente tamén a modificacions no nocello ou pé que permiten que os humanos anden sobre dúas pernas". As evidencias mostran que das 110.000 secuencias de amplificadores de xenes identificadas no xenoma humano, HACNS1 sufriu a maior parte dos seus cambios durante a evolución do home posterior á separación dos antepasados dos chimpancés.[3]
GADD45G
[editar | editar a fonte]Describiuse un amplificador preto do xene GADD45g que pode regular o crecemento do cerebro en chimpancés e outros mamíferos, pero non en humanos.[4][5] O regulador GADD45G en ratos e chimpancés é activo en rexións do cerebro nas que as células que forman o córtex, parte ventral do prosencéfalo, e tálamo están localizados e poden suprimir unha maior neuroxénese. A perda do amplificador GADD45G en humanos pode contribuír a incrementar certas poboacións neuronais e a expansión do prosencéfalo anterior en humanos.
Os amplificadores en bioloxía do desenvolvemento
[editar | editar a fonte]O desenvolvemento, diferenciación e crecemento de células e tecidos require patróns de expresión xénica regulados de forma precisa. Os amplificadores funcionan como elementos reguladores en cis que median o control espacial e temporal do desenvolvemento ao activar a transcrición en células específicas e reprimila nouras células. Así, unha particular combinación de factores de transcrición e outras proteínas de unión ao ADN nun tecido en desenvolvemento controla que xenes deben expresarse en dito tecido. Os ampliicadores posibilitan que un mesmo xene se use en diversos procesos no espazo e no tempo.
Identificación e caracterización
[editar | editar a fonte]Os amplificadores poden identificarse con técnicas chamadas de trampa de amplificador utilizando un xene reporteiro ou indicador ou por análise de secuencias comparativa e xenómica computacional. En modelos para estudos xenéticos como a mosca Drosophila melanogaster, por exemplo, pode integrarse aleatoriamente no xenoma un reporteiro como o xene lacZ utilizando un transposón elemento P. Se o xene reporteiro se integra preto dun amplificador, a súa expresión indicará o patrón de expresión dirixido polo amplificador. Así, marcando as moscas para a expresión ou actividade do xene lacZ e clonando as secuencias que rodean o sitio de integración pódese identificar a secuencia amplificadora.[6]
Utilizando unha estratexia de xenómica comparativa, a conservación de secuencias de rexións non codificantes pode ser indicativa da presenza dun amplificador. Alíñanse as secuencias de moitas especies, e identifícanse computacionalmente as rexións conservadas.[7] As secuencias identificadas poden despois ser unidas a un indicador ou reporteiro como a proteína fluorescente verde ou o xene lacZ para determinar o patrón in vivo de expresión xénica producida polo amplificador cando se inxecta nun embrión. A expresión do ARNm do reporteiro pode ser visualizada por medio dunha hibridación in situ, que proporciona unha medida máis directa da actividade do amplificador, xa que non está suxeito ás complexidades da tradución e pregamento de proteínas. Aínda que se teñen sinalado moitas evidencias de conservación de secuencia en amplificadores que interveñen no desenvolvemento en momentos chave, outros traballos indicaron que a función dos amplificadores pode ser conservada con pouca ou ningunha conservación da secuencia primaria. Por exemplo, os amplificadores RET nos humanos teñen moi pouca conservación de secuencias con respecto aos do peixe cebra, pero aínda así as secuencias de ambas as especies producen patróns de expresión de xenes reporteiros case idénticos.[7] Ademais, poden utilizarse algoritmos como TFSEARCH para identificar os sitios de unión de supostos factores de transcrición para caracterizar unha secuencia amplificadora.
Amplificadores na segmentación de invertebrados
[editar | editar a fonte]Entre os amplificadores do desenvolvemento mellor caracterizados están os amplificadores que determinan as fases iniciais da segmentación en embrións de Drosophila melanogaster. Nas fases iniciais dos embrións da mosca, os factores de transcrición do xene gap son responsables da activación e representan varios xenes de segmentación, como os xenes da regra par (actúan en segmentos embrionarios alternantes). Os xenes gap exprésanse en bloques ao longo do eixe anteroposterior da mosca xunto con outros factores de transcrición de efecto materno, creando así zonas nas que se expresan diferentes combinacións de factores de transcrición. Os xenes da regra par están en células separadas por células que non os expresan. Ademais, as bandas de expresión de diferentes xenes de regra par compénsanse con outros situados a unha distancia de poucos diámetros celulares. Así, combinacións únicas de expresión de xenes de regra par crean dominios espaciais ao longo do eixe anteroposterior para crear os 14 segmentos embrionarios. Caracterizouse o amplificador de 480 bp responsable de dirixir o xene da regra par even-skipped (eve, ~saltado par). O amplificador contén 12 sitios de unión diferentes para os factores de transcrición de xenes gap e maternos. A activación e represión dos sitios solápanse en secuencia. Eve só se expresa nunha estreita banda de células que contén altas concentracións de activadores e baixa concentración de represores para esta secuencia amplificadora. Outras rexións amplificadoras dirixen a expresión de eve noutras 6 bandas no embrión.[8]
Os amplificadores no patrón dos vertebrados
[editar | editar a fonte]O establecemento dos eixes corporais é un paso fundamental no desenvolvemento animal. Durante o desenvolvemento embrionario dos ratos, o ligando da superfamilia do factor de crecemento transformante beta chamado Nodal, é un xene chave implicado no deseño do eixe anteroposterior e o eixe esquerda-dereita do embrión nas fases iniciais. O xene Nodal contén dous amplificadores: O Amplificador de Epiblasto Proximal (PEE) e o Amplificador Asimétrico (ASE). O PEE está augas arriba do xene Nodal e dirixe a expresión de Nodal na porción da liña primitiva que se diferenciará no nodo (tamén denominado nodo primitivo).[9] O PEE activa a expresión de Nodal en resposta á combinación da sinalización de Wnt e mais un segundo sinal descoñecido; así, un membro da familia do factor de transcrición LEF/TCF probablemente se une ao sitio de unión de TCF nas células do nodo. A difusión de Nodal desde o nodo forma un gradiente que deseña a extensión do eixe anteroposterior do embrión.[10] O ASE é un amplificador intrónico unido ao factor de transcrición dominio cabeza de garfo Fox1. No desenvolvemento temperá, a expresión de Nodal dirixida por Fox1 establece o endoderma visceral. Na fase posterior do desenvolvemento, a unión de Fox1 a ASE dirixe a expresión de Nodal no lado esquerdo da placa lateral do mesoderma, establecendo así a asimetría esquerda-dereita necesaria para o desenvolvemento asimétrico de órganos no mesoderma no rato.[11]
O establecemento das tres capas xerminais durante a gastrulación é outro paso crítico no desenvolvemento animal. Cada unha das tres capas xerminais ten patróns únicos de expresión xénica que promoven a súa diferenciación e desenvolvemento. O endoderma está especificado moi cedo no desenvolvemento pola expresión de Gata4, e Gata4 pasa a dirixir a morfoxénese directa do tubo dixestivo. A expresión de Gata4 está controlada nas fases temperás embrionarias por un amplificador intrónico que se une a outro factor de transcrición de dominio de cabeza de garfo chamado FoxA2. Inicialmente, o amplificador conrola unha ampla expresión de xenes por todo o embrión, pero a expresión faise rapidamente restritiva para o endoderma, o que suxire que poden estar implicados outros represores na súa restrición. No desenvolvemento posterior, o mesmo amplificador restrinxe a expresión en tecidos que se converterán no estómago e páncreas. Outro amplificador adicional é responsable de manter a expresión de Gata4 no endoderma nos estadios intermedios do desenvolvemento do tubo dixestivo.[12]
Moitos amplificadores promoven a robustez do desenvolvemento
[editar | editar a fonte]Algúns xenes implicados en procesos fundamentais do desenvolvemento teñen moitos amplificadores de función solapada. Os amplificadores secundarios ou “amplificadores sombra” poden encontrarse a moitas quilobases de distancia desde o amplificador primario (“primario” refírese xeralmente ao primeiro amplificador descuberto, o cal normalmente está próximo ao xene que regula). Cada amplificador dirixe patróns case idénticos de expresión xénica. Algúns estudos trataron de ver se os dous amplificadores son verdadeiramente redundantes, e recentemente viuse que moitos amplificadores permiten que as moscas da froita sobrevivan ás perturbacións ambientais, como pode ser un incremento de temperatura. Cando crecen a temperatura elevada, ás veces un dos amplificador falla no seu control do patrón completo de expresión, mentres que a presenza dos dous amplificadores permite unha expresión normal dos xenes.[13]
Os amplificadores e a evolución dos mecanismos do desenvolvemento
[editar | editar a fonte]Unha área de investigación en bioloxía evolutiva do desenvolvemento (“evo-devo”) é o papel dos amplificadores e outros elementos reguladores en cis na produción de cambios morfolóxicos por medio de diferenzas de desenvolvemento entre especies.
O Pitx1 do peixe espiñento
[editar | editar a fonte]Traballos recentes estudaron o papel de amplificadores nos cambios morfolóxicos no peixe espiñento Gasterosteus aculeatus. Os peixes espiñentos viven en ambientes mariños e de auga doce, pero os peixes espiñentos en moitas poboacións de auga doce perderon completamente as súas aletas pélvicas (apéndices que son homólogos das patas posteriores dos tetrápodos). Pitx1 é un xene homeobox implicado no desenvolvemento das patas posteriores dos vertebrados. As análises xenéticas preliminares indican que os cambios na expresión deste xene eran responsables da redución pélvica no peixe espiñento. Os peixes que expresan só o alelo de auga doce do xene Pitx1 non teñen espiñas pélvicas, mentres que a expresión dun alelo mariño mantén as espiñas pélvicas. Unha caracterización máis completa mostrou que unha secuencia amplificadora situada a 500 pares de bases é a responsable de activar a expresión de Pitx1 na xema embrionaria que formará a aleta posterior. Este amplificador está localizado preto do sitio fráxil cromosómico (unha secuencia de ADN que probablemente será rota e mutada como resultado dunha reparación do ADN imprecisa). O sitio fráxil causou perdas independentes repetidas de amplificadores responsables de dirixir a expresión de Pitx1 para a formación das espiñas pélvicas na poboación de auga doce illada, e sen este amplificador, os peixes de auga doce non poden formar as espiñas pélvicas.[14]
Os amplificadores na evolución do patrón das ás de Drosophila
[editar | editar a fonte]Os patróns de pigmentación proporcionan unha das diferenzas máis rechamantes e doadas de contabilizar entre diferentes especies de animais. A pigmentación das ás de Drosophila é un sistema especialmente axeitado para estudar o desenvolvemento de fenotipos complexos de pigmentación. A á de Drosophila guttifera ten doce puntos pigmentados escuros e outras 4 manchas grises claras intervenosas. Os puntos de pigmentación orixínanse pola expresión do xene yellow (amarelo), cuxo produto prodce melanina negra. Traballos recentes atoparon que dous amplificadores no xene yellow producen a expresión xénica neste patrón preciso: o amplificador do xene das manchas dirixe a expresión do xene reporteiro nos 12 puntos pigmentados, e o amplificador da mancha ou sombreado gris intervenoso dirixe a expresión do xene reporteiro nas 4 manchas diferentes. Estes dous amplificadores son sensibles á vía de sinalización Wnt, que é activada pola expesión de wingless (sen ás) en todas as partes pigmentadas. Así, na evolución do fenotipo de pigmentación complexo, para o xene do pigmento amarelo evolucionaron amplificadores sensibles ao sinal wingless, e a expresión de wingless evolucionou en novas localizacións para producir novos patróns de ás.[15]
Notas
[editar | editar a fonte]- ↑ Spilianakis, Charalampos G.; Lalioti, Maria D.; Town, Terrence; Lee, Gap Ryol; Flavell, Richard A. (2005). "Interchromosomal associations between alternatively expressed loci". Nature 435 (7042): 637–45. PMID 15880101. doi:10.1038/nature03574.
- ↑ 2,0 2,1 2,2 Arnosti, David N.; Kulkarni, Meghana M. (2005). "Transcriptional enhancers: Intelligent enhanceosomes or flexible billboards?" (PDF). Journal of Cellular Biochemistry 94 (5): 890–8. PMID 15696541. doi:10.1002/jcb.20352. Arquivado dende o orixinal (PDF) o 21 de xullo de 2006. Consultado o 22 de agosto de 2018.
- ↑ HACNS1: Gene enhancer in evolution of human opposable thumb
- ↑ McLean, Cory Y.; Reno, Philip L.; Pollen, Alex A.; Bassan, Abraham I.; Capellini, Terence D.; Guenther, Catherine; Indjeian, Vahan B.; Lim, Xinhong; Menke, Douglas B. (2011). "Human-specific loss of regulatory DNA and the evolution of human-specific traits". Nature 471 (7337): 216–9. PMC 3071156. PMID 21390129. doi:10.1038/nature09774.
- ↑ New Scientist, 12 March 2011, pages 3, 6-7
- ↑ Hartenstein, Volker; Jan, Yuh Nung (1992). "Studying Drosophila embryogenesis with P-lacZ enhancer trap lines". Roux's Archives of Developmental Biology 201 (4): 194–220. doi:10.1007/BF00188752.
- ↑ 7,0 7,1 Visel, Axel; Bristow, James; Pennacchio, Len A. (2007). "Enhancer identification through comparative genomics". Seminars in Cell & Developmental Biology 18: 140–152. doi:10.1016/j.semcdb.2006.12.014.
- ↑ Borok, M. J.; Tran, D. A.; Ho, M. C. W.; Drewell, R. A. (2009). "Dissecting the regulatory switches of development: Lessons from enhancer evolution in Drosophila". Development 137 (1): 5–13. PMC 2796927. PMID 20023155. doi:10.1242/dev.036160.
- ↑ Norris, D. P.; Robertson, E. J. (1999). "Asymmetric and node-specific nodal expression patterns are controlled by two distinct cis-acting regulatory elements". Genes & Development 13 (12): 1575–88. PMC 316799. PMID 10385626. doi:10.1101/gad.13.12.1575.
- ↑ Granier, Céline; Gurchenkov, Vasily; Perea-Gomez, Aitana; Camus, Anne; Ott, Sascha; Papanayotou, Costis; Iranzo, Julian; Moreau, Anne; Reid, John (2011). "Nodal cis-regulatory elements reveal epiblast and primitive endoderm heterogeneity in the peri-implantation mouse embryo". Developmental Biology 349 (2): 350–62. PMID 21047506. doi:10.1016/j.ydbio.2010.10.036.
- ↑ Norris, DP; Brennan, J; Bikoff, EK; Robertson, EJ (2002). "The Foxh1-dependent autoregulatory enhancer controls the level of Nodal signals in the mouse embryo". Development 129 (14): 3455–68. PMID 12091315.
- ↑ Rojas, Anabel; Schachterle, William; Xu, Shan-Mei; Martín, Franz; Black, Brian L. (2010). "Direct transcriptional regulation of Gata4 during early endoderm specification is controlled by FoxA2 binding to an intronic enhancer". Developmental Biology 346 (2): 346–55. PMC 2945415. PMID 20692247. doi:10.1016/j.ydbio.2010.07.032.
- ↑ Perry, Michael W.; Boettiger, Alistair N.; Bothma, Jacques P.; Levine, Michael (2010). "Shadow Enhancers Foster Robustness of Drosophila Gastrulation". Current Biology 20 (17): 1562–1567. PMID 20797865. doi:10.1016/j.cub.2010.07.043.
- ↑ Chan, Y. F.; Marks, M. E.; Jones, F. C.; Villarreal, G.; Shapiro, M. D.; Brady, S. D.; Southwick, A. M.; Absher, D. M.; Grimwood, J. (2009). "Adaptive Evolution of Pelvic Reduction in Sticklebacks by Recurrent Deletion of a Pitx1 Enhancer". Science 327 (5963): 302–305. PMC 3109066. PMID 20007865. doi:10.1126/science.1182213.
- ↑ Werner, Thomas; Koshikawa, Shigeyuki; Williams, Thomas M.; Carroll, Sean B. (2010). "Generation of a novel wing colour pattern by the Wingless morphogen". Nature 464 (7292): 1143–1148. PMID 20376004. doi:10.1038/nature08896.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- MeshName - Enhancer+Elements,Genetic [1]
- TFSEARCH
- JASPAR
- ENCODE threads explorer Descubrimento e caracterización de amplificadores xenéticos. Revista Nature
