Somatostatina
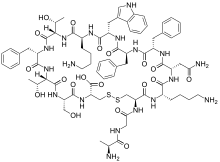
A somatostatina, tamén chamada hormona inhibidora da hormona do crecemento (GHIH) ou factor inhibidor da liberación de somatotropina (SRIF), é unha hormona peptídica, que regula o sistema endócrino e afecta á neurotransmisión e á proliferación celular por medio da súa interacción con receptores da somatostatina acoplados á proteína G e a inhibición da liberación de moitas hormonas secundarias.
A somatostatina ten dúas formas activas producidas pola rotura en sitios alternativos dunha preproteína. Unha destas formas ten 14 aminoácidos, e a outra ten 28.[1]
No conxunto dos vertebrados, existen seis xenes da somatostatina, denominados SS1, SS2, SS3, SS4, SS5, e SS6. Os tetrápodos posúen só os xenes SS1 e SS2, que no home están situados no cromosoma 3, e os peixes teleósteos posúen os seis.[2] Estes seis xenes, xunto cos cinco receptores da somatostatina diferentes que hai, permiten que a somatostatina teña numerosas funcións.[3]
Produción
[editar | editar a fonte]No aparato dixestivo
[editar | editar a fonte]A somatostatina secrétase en varias localizacións no aparato dixestivo:
No cerebro
[editar | editar a fonte]A somatostatina prodúcese polas neuronas neuroendócrinas do núcleo periventricular do hipotálamo. Estas neuronas envían proxeccións á eminencia media, onde a somatostatina se libera polas terminacións nerviosas neurosecretoras no sistema portal sanguíneo hipotalámico-hipofisario. A somatostatina é despois levada á adenohipófise (ou pituitaria anterior), onde inhibe a secreción da hormona do crecemento (GH) polas células somatotropas. As neuronas da somatostatina do núcleo periventricular median o efecto de retroalimentación negativa da hormona do crecemento sobre a súa propia liberación; as neuronas da somatostatina responden ás concentracións altas de hormona do crecemento circulante e de somatomedinas incrementando a liberación de somatostatina, para reducir así a secreción de hormona do crecemento.
A somatostatina é tamén producida por outras poboacións de neuronas, que se proxectan a outras áreas do cerebro, e os receptores da somatostatina exprésanse en varios lugares do cerebro.
Accións
[editar | editar a fonte]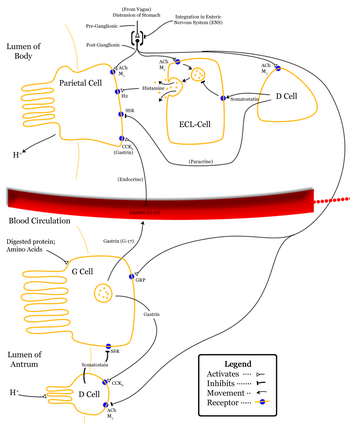
A somatostatina clasifícase como unha hormona inhibitoria,[1] que exerce efectos en diferentes partes do corpo:
Adenohipófise
[editar | editar a fonte]Na adenohipófise (pituitaria anterior), os efectos da somatostatina son:
- Inhibe a liberación da hormona do crecemento (GH)[5] (opoñéndose así aos efectos da hormona liberadora da hormona do crecemento (GHRH))
- Inhibe a liberación da hormona estimulante da tiroide (TSH)[6]
Sistema gastrointestinal
[editar | editar a fonte]- A somatostatina é homólogo da cortistatina (un membro da familia da somatostatina de proteínas) e suprime a liberación de hormonas gastrointestinais como:
- Gastrina.
- Colecistoquinina (CCK).
- Secretina.
- Motilina.
- Péptido intestinal vasoactivo (VIP).
- Polipéptido inhibidor gástrico (GIP).
- Enteroglicagón.
- Fai decrecer o ritmo de baleiramento gástrico, e reduce as contraccións do músculo liso e o fluxo de sangue no intestino [5].
- Suprime a liberación de hormonas pancreáticas.
- Inhibe a liberación de insulina cando as células delta do páncreas liberan somatostatina [7].
- Inhibe a liberación de glicagón[7].
- Suprime a acción secretora exócrina pancreática.
- Inhibe a adenil ciclase nas células parietais gástricas.
Historia evolutiva
[editar | editar a fonte]Nos vertebrados descubríronse seis xenes da somatostatina. A explicación actual da historia de como apareceron estes seis xenes baséase na existencia de tres eventos de duplicación de todo o xenoma que tiveron lugar na evolución dos vertebrados xunto con duplicacións locais nos peixes teleósteos. Un xene ancestral da somatostatina duplicaríase durante o primeiro evento de duplicación de todo o xenoma (1R), creando os xenes SS1 e SS2. Estes dous xenes duplicáronse outra vez durante o segundo evento de duplicación de todo o xenoma (2R) creando catro novos xenes de somatostatina: SS1, SS2, SS3, e un xene que se perdeu durante a evolución dos vertebrados. Os tetrápodos mantiveron o SS1 (tamén coñecido como SS-14 e SS-28) e o SS2 (tamén coñecido como cortistatina) despois de separarse en sarcopterixios e actinopterixios. Nos peixes teleósteos, duplicáronse SS1, SS2, e SS3 durante o terceiro evento de duplicación de todo o xenoma (3R), creando os xenes SS1, SS2, SS4, SS5, e dous xenes que se perderon durante a evolución dos teleósteos. SS1 e SS2 sufriron duplicacións locais dando lugar a SS6 e SS3.[2]
Uso clínico
[editar | editar a fonte]A vida media da somatostatina é de só uns minutos, o que a fai pouco axeitada para o seu uso clínico. No seu lugar empréganse "análogos da somatostatina", como o octreótido e lanreótido, que posúen unha vida media de horas. Son especialmente útiles no tratamento do VIPoma e a acromegalia.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Costoff A. "Sect. 5, Ch. 4: Structure, Synthesis, and Secretion of Somatostatin". Endocrinology: The Endocrine Pancreas. Medical College of Georgia. pp. page 16. Arquivado dende o orixinal o 05 de abril de 2008. Consultado o 2008-02-19.
- ↑ 2,0 2,1 Liu Y., Lu D. Q., Zhang Y., Li S. S., Liu X. C., Lin H. R. (2010). "The evolution of somatostatin in vertebrates". Gene 463 (1–2): 21–28. PMID 20472043. doi:10.1016/j.gene.2010.04.016.
- ↑ Gahete M. D., Cordoba-Chacon J., Duran-Prado M., Malagon M. M., Martinez-Fuentes A. J., Gracia-Navarro F., Luque R. M., Castano J. P. (2010). "Somatostatin and its receptors from fish to mammals". Annals of the New York Academy of Sciences 1200: 43–52. PMID 20633132. doi:10.1111/j.1749-6632.2010.05511.x.
- ↑ Costanzo, Linda S. (2003). Lippincott Williams & Wilkins - Hagerstown, MD, ed. Physiology (3rd ed.). pp. 280. ISBN 0-7817-3919-5.
- ↑ 5,0 5,1 Bowen R (2002-12-14). "Somatostatin". Biomedical Hypertextbooks. Colorado State University. Arquivado dende o orixinal o 22 de maio de 2023. Consultado o 2008-02-19.
- ↑ First Aid for the USMLE Step 1, 2010. Page 286.
- ↑ 7,0 7,1 Costoff A. "Sect. 5, Ch. 4: Structure, Synthesis, and Secretion of Somatostatin". Endocrinology: The Endocrine Pancreas. Medical College of Georgia. pp. page 17. Arquivado dende o orixinal o 31 de marzo de 2008. Consultado o 2008-02-19.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Florio T, Schettini G (2002). "[Somatostatin and its receptors. Role in the control of cell proliferation]". Minerva Endocrinol. 26 (3): 91–102. PMID 11753230.
- Yamada Y, Reisine T, Law SF; et al. (1993). "Somatostatin receptors, an expanding gene family: cloning and functional characterization of human SSTR3, a protein coupled to adenylyl cyclase". Mol. Endocrinol. 6 (12): 2136–42. PMID 1337145. doi:10.1210/me.6.12.2136.
- Yamada Y, Post SR, Wang K; et al. (1992). "Cloning and functional characterization of a family of human and mouse somatostatin receptors expressed in brain, gastrointestinal tract, and kidney". Proc. Natl. Acad. Sci. U.S.A. 89 (1): 251–5. PMC 48214. PMID 1346068. doi:10.1073/pnas.89.1.251.
- Brazeau P, Vale W, Burgus R; et al. (1973). "Hypothalamic polypeptide that inhibits the secretion of immunoreactive pituitary growth hormone". Science 179 (4068): 77–9. PMID 4682131. doi:10.1126/science.179.4068.77.
- Shen LP, Pictet RL, Rutter WJ (1982). "Human somatostatin I: sequence of the cDNA". Proc. Natl. Acad. Sci. U.S.A. 79 (15): 4575–9. PMC 346717. PMID 6126875. doi:10.1073/pnas.79.15.4575.
- Shen LP, Rutter WJ (1984). "Sequence of the human somatostatin I gene". Science 224 (4645): 168–71. PMID 6142531. doi:10.1126/science.6142531.
- Montminy MR, Goodman RH, Horovitch SJ, Habener JF (1984). "Primary structure of the gene encoding rat preprosomatostatin". Proc. Natl. Acad. Sci. U.S.A. 81 (11): 3337–40. PMC 345502. PMID 6145156. doi:10.1073/pnas.81.11.3337.
- Zabel BU, Naylor SL, Sakaguchi AY; et al. (1984). "High-resolution chromosomal localization of human genes for amylase, proopiomelanocortin, somatostatin, and a DNA fragment (D3S1) by in situ hybridization". Proc. Natl. Acad. Sci. U.S.A. 80 (22): 6932–6. PMC 390100. PMID 6196780. doi:10.1073/pnas.80.22.6932.
- Panetta R, Greenwood MT, Warszynska A; et al. (1994). "Molecular cloning, functional characterization, and chromosomal localization of a human somatostatin receptor (somatostatin receptor type 5) with preferential affinity for somatostatin-28". Mol. Pharmacol. 45 (3): 417–27. PMID 7908405.
- Demchyshyn LL, Srikant CB, Sunahara RK; et al. (1993). "Cloning and expression of a human somatostatin-14-selective receptor variant (somatostatin receptor 4) located on chromosome 20". Mol. Pharmacol. 43 (6): 894–901. PMID 8100352.
- Kaupmann K, Bruns C, Hoyer D; et al. (1993). "Distribution and second messenger coupling of four somatostatin receptor subtypes expressed in brain". FEBS Lett. 331 (1–2): 53–9. PMID 8405411. doi:10.1016/0014-5793(93)80296-7.
- Aguila MC, Rodriguez AM, Aguila-Mansilla HN, Lee WT (1996). "Somatostatin antisense oligodeoxynucleotide-mediated stimulation of lymphocyte proliferation in culture". Endocrinology 137 (5): 1585–90. PMID 8612489. doi:10.1210/en.137.5.1585.
- Sharma K, Patel YC, Srikant CB (1997). "Subtype-selective induction of wild-type p53 and apoptosis, but not cell cycle arrest, by human somatostatin receptor 3". Mol. Endocrinol. 10 (12): 1688–96. PMID 8961277. doi:10.1210/me.10.12.1688.
- Dournaud P, Boudin H, Schonbrunn A; et al. (1998). "Interrelationships between somatostatin sst2A receptors and somatostatin-containing axons in rat brain: evidence for regulation of cell surface receptors by endogenous somatostatin". J. Neurosci. 18 (3): 1056–71. PMID 9437026.
- Barnea A, Roberts J, Ho RH (1999). "Evidence for a synergistic effect of the HIV-1 envelope protein gp120 and brain-derived neurotrophic factor (BDNF) leading to enhanced expression of somatostatin neurons in aggregate cultures derived from the human fetal cortex". Brain Res. 815 (2): 349–57. PMID 9878821. doi:10.1016/S0006-8993(98)01098-1.
- Ferone D, van Hagen PM, van Koetsveld PM; et al. (1999). "In vitro characterization of somatostatin receptors in the human thymus and effects of somatostatin and octreotide on cultured thymic epithelial cells". Endocrinology 140 (1): 373–80. PMID 9886848. doi:10.1210/en.140.1.373.
- Brakch N, Lazar N, Panchal M; et al. (2002). "The somatostatin-28(1-12)-NPAMAP sequence: an essential helical-promoting motif governing prosomatostatin processing at mono- and dibasic sites". Biochemistry 41 (5): 1630–9. PMID 11814357. doi:10.1021/bi011928m.
- Oomen SP, van Hennik PB, Antonissen C; et al. (2002). "Somatostatin is a selective chemoattractant for primitive (CD34(+)) hematopoietic progenitor cells". Exp. Hematol. 30 (2): 116–25. PMID 11823046. doi:10.1016/S0301-472X(01)00772-X.
- Simonetti M, Di BC (2002). "Structural motifs in the maturation process of peptide hormones. The somatostatin precursor. I. A CD conformational study". J. Pept. Sci. 8 (2): 66–79. PMID 11860030. doi:10.1002/psc.370.
