Implantación (embrioloxía)

A implantación, tamén chamada nidación[1] é o estadio do desenvolvemento embrionario dos mamíferos placentarios, no cal o blastocisto eclosiona, fíxase e adhire e invade a parede do útero da femia.[2] A implantación é o primeiro estadio da xestación, e, cando se realiza con éxito, a femia considérase que está preñada.[3] Un embrión implantado é detectado polo aumento dos niveis de gonadotropina coriónica humana (hCG) nun test de embarazo.[3] O embrión implantado recibe oxíxeno e nutrientes para crecer.
Para que teña lugar a implantación, o útero debe facerse receptivo. A receptividade uterina implica moitas interaccións (crosstalk) entre o embrión e o útero, o que inicia os cambios no endometrio. Este estadio xera unha sincronía que abre unha ventá de implantación que permite unha implantación exitosa dun embrión viable.[4] O sistema endocannabinoide xoga un papel vital nesta sincronía no útero, influíndo na receptividade uterina e na implantación do embrión.[5] O embrión expresa receptores cannabinoides bastante cedo no seu desenvolvemento, que son receptivos á anandamida (AEA) segregada no útero. A anandamida prodúcese a nivel alto antes da implantación e despois é regulada á baixa no momento da implantación. Esta sinalización é importante nas interaccións embrión-útero na regulación da cronoloxía da implantación embrionaria e a receptividade uterina. Para unha correcta implantación cómpre unha concentración adecuada de anandamida que non sexa nin demasiado alta nin demasiado baixa.[5][6][7]
Hai unha ampla variación nos tipos de células trofoblasticas e de estruturas da placenta nas diferentes especies de mamíferos.[8] Dos cinco estadios recoñecidos da implantación incluíndo dous estadios de preimplantación que precede á placentación, os primeiros catro son similares nas distintas especies. Os cinco estadios ou etapas son: migración e eclosión, precontacto, fixación, adhesión e invasión.[8] Os dous estadios preimplantación están asociados co embrión preimplantación.[9][10]
En humanos o proceso de implantación empeza despois do estadio de eclosión, que ten lugar arredor de catro ou cinco días despois da fecundación. Ao final da primeira semana, o blastocisto está fixado superficialmente ao endometrio uterino. Ao final da segunda semana, a implantación está completa.[11]
Estadios da implantación
[editar | editar a fonte]Recoñécense cinco estadios na implantación dos mamíferos, que comprenden dous estadios preimplantación que preceden á formación da placenta. Son: migración e eclosión, precontacto, fixación, adhesión e invasión. Os primeiros catro estadios son similares nas distintas especies, mais o proceso de invasión é variable.[8][12] Outra terminoloxía dos tres últimos estadios é: aposición, fixación e invasión, que se poden denominar alternativamente contacto (aposición), adhesión (fixación) e penetración (invasión),[10][9] e só poden ter lugar durante un marco de tempo limitado coñecido como ventá de implantación, na cal o útero ten a máxima receptividade.
Preimplantación: migración e eclosión
[editar | editar a fonte]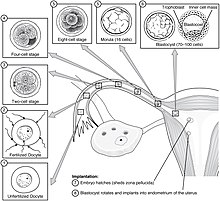
Hai dous estadios de migración implicados na implantación, o primeiro é a migación do cigoto, e o segundo é a migración do trofoblasto.[13] A fecundación do ovocito ten lugar nas ampolas das trompas de Falopio. Os cilios que tapizan o interior das trompas moven o cigoro na súa migración cara ao útero.
Durante esta migración o cigoto sofre varias divisións celulares que crean unha bóla de 16 blastómeros compacta chamada mórula.[14] A mórula entra no útero tres ou catro días despois, e conforme o fai créase no seu interior unha cavidade chamada blastocele, o que a transforma no blastocisto. O blastocisto contén a masa celular interna ou embrioblasto, que seguirá desenvolvéndose ata orixinar o embrión propiamente dito, e unha capa de células externa de trofoblastos que se desenvolverá formando as membranas extraembrionarias (membranas fetais).[15]
O blastocisto aínda segue dentro da cuberta do ovo chamada zona pelúcida, e para que poida implantarse na parede uterina debe saír desta cuberta. Este estadio denomínase eclosión da zona, e cando hai unha disolución suficiente da zona, o blastocisto pode iniciar o estadio de aposición da implantación. Factores líticos da cavidade uterina, así como factores do propio blastocisto son esenciais para a rotura da cuberta do ovo. Os mecanismos só se dan en ovocitos fecundados, xa que se situamos unha célula ovo non fecundada no útero nas mesmas condicións, a zona pelúcida permanece intacta.[16]
Entre os reguladores moleculares coñecidos que promoven a eclosión están predominantemente proteases que son estimuladas por varios factores de crecemento.[17] O blastocisto tamén produce citocinas, tanto proinflamatorias coma antiinflamatorias, que teñen un papel crucial durante a implantación e outros estadios do embarazo. Ambos os tipos de citocinas modulan a actividade das proteases, incluíndo metaloproeinases de matriz (MMPs), activadores do plasminóxeno e catepsinas.[17] Non se sabe se as citocinas implicadas na eclosión son proinflamatorias ou antiinflamatoria, ou cales son as proteases implicadas. Porén, está ben aceptado que as citocinas proinflamatorias son dominantes durante a implantación. As citocinas están tamén presentes no chamado leite uterino, que podería regular o desenvolvemento e función do blastocisto, pero non hai evidencias que apoien a súa intervención na eclosión. O factor inhibidor da leucemia (LIF) é unha citocina proinflamatoria expresada no endometrio durante a fase lútea do ciclo menstrual, cuxa máxima expresión se observa durante a ventá de implantación. O LIF exerce unha importante función na adhesión e invasión.[17]
Na reprodución asistida pode realizarse unha eclosión da zona asistida, na cal a zona pelúcida pode ser perforada artificialmente para facilitar a eclosión.[18]
Aposición
[editar | editar a fonte]Despois da eclosión da zona, a conexión pouco firme máis inicial ou contacto entre o blastocisto e o endometrio denomínase aposición. A aposición faise xeralmente alí onde hai unha pequena cripta no endometrio, e tamén na parte onde houbo unha rotura suficiente da zona pelúcida que permita que o trofoblasto do blastocisto contacte directamente co endometrio que ten debaixo. Finalmente, a masa celular interna (tamén chamada embrioblasto), que está dentro da capa do trofoblasto, alíñase moi preto da decidua. Se a masa celular interna non está aliñada coa decidua na aposición, ten a capacidade de rotar libremente dentro do trofoblasto ata conseguir o aliñamento. A aposición é só unha interacción feble do trofoectodermo co epitelio uterino que é inestable ante estreses mecánicos. A aposición é tamén reversible, polo que é posible un reposicionamento do blastocisto no útero.[14]
Adhesión
[editar | editar a fonte]A adhesión é unha unión moito máis forte co endometrio que a aposición feble anterior.
Os trofoblastos adhírense penetrando no endometrio, con protrusións de células trofoblásticas.
Esta actividade de adhesión faise por medio de microvilosidades que hai no trofoblasto. O trofoblasto ten conexión fibrilares de unión, laminina, coláxeno de tipo IV, e integrinas que axudan neste proceso de adhesión.[19]
A mucina-16 é unha mucina transmembrana expresada na superficie apical do epitelio uterino. Esta mucina impide que o blastocisto se implante nun lugar non axeitado do epitelio. Así, a MUC-16 inhibe a adhesión célula-célula. A súa reirada durante a formación do pinópodo facilita a invasión do trofoblasto in vitro.[20]
A identidade das moléculas no trofoblasto e o epitelio endometrial que funcionan como mediadoras da interacción inicial entre ambos non foi identificada. No entanto, varios grupos de investigadores propuxeron que está implcada a MUC1, un membro da familia da mucina de proteínas glicosiladas.[21] A MUC1 é unha glicoproteína transmembrana expresada na superficie apical das células epiteliais endometriais durante a ventá de implantación en humanos e exprésase diferencialmente en suxeitos fértiles e infértiles durante ese período.[21] A MUC1 mostra restos de carbohidratos no seu dominio extracelular que son ligandos da L-selectina, unha molécula de adhesión celular da superficie das células trofoblásticas.[22][23] Nun modelo in vitro da implantación obtivéronse evidencias que apoian a hipótese de que a L-selectina é mediadora na aposición dos blastocistos ao epitelio uterino ao interaccionar cos seus ligandos.[24]
Invasión
[editar | editar a fonte]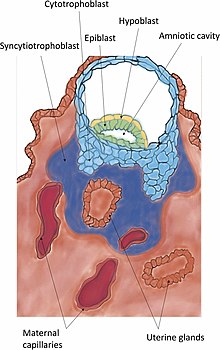
A invasión é o establecemento definitivo do blastocisto no endometrio. As protrusións das células trofoblásticas que se adhiren ao endometrio continúan proliferando e penetrando no endometrio usando as xelatinases A e B.[25] Os trofoblastos invaden o útero intentando chegar ás fontes de sangue materno, para crear os fundamentos do fluxo sanguíneo fetal.[26] Tamén segregan o factor de preimplantación, un pétido que axuda á implantación e á formación da placenta.[27] A medida que estes trofoblastos penetran, fusiónanse cos seus veciños, diferenciándose terminalmente nun tecido multinucleado, un sincitio coñecido como sincitiotrofoblasto. Entre esta capa e o blastocisto encóntrase o citotrofoblasto.[28][29]
Cando o sincitiotrofoblasto acada a membrana basal baixo as células deciduais, retíraas ou desprázaas para poder invadir mellor o estroma uterino. Esta retirada das células realízase degradando as moléculas de adhesión celular (CAMs) que manteñen unidas as células da decidua, e a matriz extracelular asociada. A degradación conséguese pola secreción de factor de necrose tumoral alfa polo sincitiotrofoblasto, o cal inhibe a expresión das moléculas de adhesión celular e da beta-catenina. A matriz extracellar degrádase pola acción de metaloproteinases como colaxenases, xelatinases e metaloproteinases de matriz e por serina proteases.[30] As colaxenases dixiren os coláxenos de tipo I, II, III, VII e X.[30] Hai dúas formas de xelatinases; unha dixire o coláxeno de tipo IV e outra a xelatina.[30] A matriz extracelular é degradada por serina endopeptidases e metaloproteinases. O sincitiotrofoblasto pode despois invadir o endometrio levando o embrión con el, o cal queda incrustado.[30] Finalmente, o sinciotiotrofoblasto ponse en contacto co sangue materno e forma as vilosidades coriónicas, o que é o comezo da placentación. Despois da invasión, a brecha formada no epitelio uterino pola entrada do blastocisto é selada por un tapón de fibrina. O tapón de fibrina é unha coagulación de sangue con restos celulares.[11]
Trofoblastos extravilosos
[editar | editar a fonte]Os trofoblastos extavilosos son células das vilosidades invasoras que migran ao miometrio do útero materno. Estas células remodelan as arterias espirais para mellorar e asegurar o fluxo sanguíneo materno que chega ao embrión. Hai probas de que este proceso ocorre tamén coas ves uterinas, estabilizándoas para mellorar a drenaxe do sangue fetal e de residuos metbólicos.[31] Tamén se documentou que os trofoblastos que migran a varios tecidos da nai, como o tecido hepático e medula ósea. Debido a isto, os trofoblastos foron implicados nun fenómeno chamado microquimerismo fetomaternal no que as células fetais establecen liñas celulares nos tecidos maternos, que poden pesistir na nai por décadas.[32]
Secrecións
[editar | editar a fonte]Os blastocistos preimplantación poden segregar factores de crecemento, hormonas e proteases similares á tripsina para participaren no proceso de eclosión.[33]
Durante a invasión, o blastocisto segrega factores para multitude de propósitos.[33] Segrega varios factores autócrinos, que actúan sobre el mesmo, estimulándoo a proseguir a invasión do endometrio. A gonadotropina coriónica humana (hCG) funciona como un factor de crecemento autócrino para o blastocisto, mentres que o factor de crecemento similar á insulina 2, estimula a súa invasividade.[30] A gonadotropina coriónica humana non só actúa como inmunosupresor, senón tamén sinala á nai que está preñada, impedindo a luteólise do corpo lúteo e a menstruación ao manter o funcionamento do corpo lúteo.[30] As secrecións afrouxan a unión entre as células da decidua, impedindo que o embrión sexa rexeitado pola nai, desencadeando o final da decidualización e impedindo a menstruación. As células trofoblásticas segregan o factor de preimplantación antes da formación da placenta.[27]
Inmunosupresor
[editar | editar a fonte]O embrión difire antixenicamente das células da nai, e sería rexeitado como un parasito ou compoñente alleo polo sistema inmunitario da nai se non segregase axentes inmunosupresores. Entre tales axentes están os seguintes: factor activador das plaquetas, gonadotropina coriónica humana, factor do embarazo temperán, prostaglandina E2, interleucina-1 alfa, interleucina 6, interferón-alfa, factor inhibidor da leucemia e factor estimulante das colonias.[Cómpre referencia]
Outros factores
[editar | editar a fonte]Outros factores segregados polo blastocisto son;[Cómpre referencia]
- Factor liberador de histamina derivado do embrión
- Activador do plasminóxeno tisular así como os seus inhibidores
- Estradiol
- β1-integrinas
- Factor de crecemento dos fibroblastos
- Factor de crecemento transformante alfa
- Inhibina
Receptividade do útero
[editar | editar a fonte]Para que sexa posible a implantación, o útero experimenta cambios para poder recibir o conceptus. A receptividade comprende cambios nas células endometrais na formación de pinópodos que axudan a absorber os fluídos uterinos; cambios no grosor do endometrio e o desenvolvemento da súa subministración de sangue, e formación da decidua. Colectivamente estes cambios coñécense como transformación da membrana plasmática, e achegan máis o blastocisto ao endometrio e inmobilízano. Durante este estadio o blastocisto aínda pode ser eliminado ao ser arrastrado polos líquidos do útero.[34][35]
Unha implantación co éxito é codependente da viabilidade do embrión e da receptividade do útero.[4] Un factor crítico implicado é o desenvolvemento dunha sincronía entre o embrión e o útero.[36] A sincronía crea un curto período de receptividade coñecido como ventá de implantación, e implica moitas interaccións entre o blastocisto e o endometrio neste estadio.[37][38][39]
O sistema endocannabinoide xoga un papel vital na súa sincronía no útero, influíndo na receptividade uterina, e a implantación do embrión.[5] O embrión expresa receptores de cannabinoides temperanmente no seu desenvolvemento que responden á anandamida (AEA) segregada polo útero. Esta sinalización é impotante na interacción embrión-útero na regulación da cronoloxía da implantación do embrión e a receptividade uterina. Para unha implantación con éxito son necesarias concentracións adecuadas de anandamida que non sexan nin demasiado altas nin baixas.[5][40] A IL-6 e a amida de ácido graxo hidrolase (FAAH) son ambas cruciais para a receptividade uterina e xunto coa anandamida están ligadas co grosor endometial adecuado que sostén o embarazo.[5]
Durante a adhesión as comunicacións son realizadas polas interaccións receptor-ligando, tanto integrina-matriz coma co proteoglicano. Os receptores de proteoglicano atópanse na superficie da decidua, e os seus ligandos proteoglicanos atópanse arredor das células trofoblásticas do blastocisto. Este sistema ligando-receptor está tamén presente xusto na ventá de implantación.[30] O blastocisto envía sinais ao endometrio para adaptarse mellor á súa presenza, por exemplo por cambios no citoesqueleto das células deciduais. Isto, á súa vez, separa as células deciduais da súa conexión coa lámina basal subxacente, o que permite que o blastocisto realice unha invasión con éxito.[30]
Ventá de implantación
[editar | editar a fonte]A ventá de implantación é un marco temporal limitado pola fixación con éxito do blastocisto.[41] Na receptividade uterina humana é óptima nos días 20-24 da fase secretora do ciclo menstrual cando os niveis da hormona luteinizante están no seu pico.[9][42] A comunicación entre o embrión e o endometrio ten lugar durante este período.[9] As células epiteliais endoteliais que tapizan o útero son as primeiras células que detectan sinais do blastocisto, e son transducidas en vías de sinalización augas abaixo.[33] En humanos a ventá de implantación só está aberta durante 24–36 horas.[43]
O microbioma endometrial ten un importante papel na implantación ao controlar o funcionamento das células endometriais, e a función do sistema inmunitario local que impide o crecemento de patóxenos. Isto está asociado coa secreción de substancias protectoras.[44][45]
Pinópodos
[editar | editar a fonte]Os pinópodos fórmanse ao principio da ventá de implantación e atópanse en moitas especies.[46][41] Son protrusións con forma de cogomelo que saen da membrana celular apical das células epiteliais uterinas.[41] Os pinópodos fórmanse polo inchamento das células epiteliais e a fusión de varias das microvilosidades para acadar o tamaño máximo.[46] Aparecen entre os días 19 e 21 de idade xestacional e están xa completamente formados no día 20.[41] Isto corresponde a unha idade de fecundación de aproximadamente cinco ou sete días, que se corresponde ben co tempo de implantación. Os pinópodos só persisten por un máximo de dous días e considéranse marcadores ultraestruturais da receptividade.[46]
O seu desenvolvemento é potenciado pola proxesterona e inhibido polos estróxenos. Durante a ventá de implantación, a adhesión célula-célula é inhibida por MUC1, unha glicoproteína da superfice celular, que pertence ao glicocáliz. Os pinópodos son máis longos que as microvilosidades e protruden a través do glicocáliz permitindo un contacto directo co trofoblasto adherente. O atriburt máis importante dos pinópodos é a súa retirada de glicoproteínas da superficie das células epiteiliais uterinas.[9] A MUC16 desaparece da superficie celular co desenvolvemento dos pinópodos. Algúns estudos informaron que os pinópodos atrapan cilios, o cal prevén o movemento do embrión, e durante a implantación permite un estreito contacto e adherencia do embrión.[41]
Os pinópodos traen fluído uterino e as súas macromoléculas ás células polo proceso de endocitose. Isto diminúe o volme do útero, poñendo as paredes máis próximas ao blastocisto que flota nel. Así, o período de pinólpodos activos podería limitar a ventá de impolantación.[30] Os pinópodos continúan a absorber fluídos, eliminando a maioría del durante as primeiras etapas da implantación.
Predecidualización
[editar | editar a fonte]O endometrio incrementa o seu grosor, vascularízase e as súas glándulas crecen ata facerse tortuosas e aumentan a súa secreción. Estes cambio chegan ao seu máximo uns sete días despois da ovulación.
Ademais, a superficie do endometrio produce un tipo de células redondeadas, que cobren a área total da cavidade uterina. Isto ocorre uns 9 a 10 días despois da ovulación.[30] Estas células denomínanse células deciduais, e a capa completa destas células despréndese en cada menstruación se non hai embarazo. As glándulas uterinas diminúen a súa actividade e dexeneran arredor dos días 8 ou 9[30] despois da ovulación en ausencia de embarazo.
As células deciduais orixínanse das células estromáticas que están sempre presentes no endometrio e constitúen unha nova capa, a decidua. O resto do endometrio expresa diferenzas entre os lados luminal e basal. As células luminais forman o estrato compacto do endometrio, en contraste co estrato esponxoso basolateral, que consta de células estromáticas bastante esponxosas.[30]
Decidualización
[editar | editar a fonte]
A decidualización aumenta se se produce o embarazo, desenvolvendo máis as glándulas uterinas, a zona compacta e o epitelio de células deciduais que a tapiza. As células deciduais énchense de lípidos e glicóxeno e adoptan a forma poliédrica característica das células deciduais. Factores procedentes do blastocisto tamén afectan a formación final das células deciduais. En contraste, algunhas células deciduais próximas ao blastocisto dexeneran, servindo para proporcionarlle nutrientes.[30] Unha indicación da influencia embrional é que a decidualización ocorre nun maior grao en ciclos de concepción que en ciclos de non concepción.[30] Ademais, obsérvanse cambios similares cando se dá un estímulo que imita a invasión natural do embrión.[30]
O embrión libera serina proteases que causan que a membrana da célula epitelial se despolarice e activa as canles de sodio epiteliais. Isto orixina un influxo de ións calcio (Ca2+) e a fosforilación da proteína CREB. A fosforilación de CREB regula á alza a expresión de COX2, o que leva á liberación de prostaglandina E2 (PGE2) polas células epiteliais. A PGE2 actúa sobre as células do estroma activando as vías relacionadas co AMP cíclico nas células estromáticas, orixinando decidualización.[47]
Partes da decidua
[editar | editar a fonte]A decidua pode dividirse en tres seccións, aínda que teñen a mesma composición. Estas son:
- Decidua basal. É a parte da decidua que está localizada basalolateralmente ao embrión despois da implantación.
- Decidua capsular. Crece sobre o embrión sobre o lado luminal, encerrándoo no endometrio. Rodea o embrión xunto coa decidua basal.
- Decidua parietal. É o resto da decidua da superficie uterina.
A decidua durante o embarazo
[editar | editar a fonte]Despois da implantación a decidua permanece durante polo menos o primeiro trimestre de xestación.[30] Porén, o momento en que é máis prominente é nas primeiras etapas do embarazo, durante a implantación. A súa función como tecido que rodea o embrión é substituída despois pola placenta definitiva. Pero algúns elementos da decidualización permanecen durante todo o embarazo.[30]
As capas compacta e esponxosa aínda son observables baixo a decidua no embarazo. As glándulas da capa esponxosa continúan segregando durante o primeiro trimestre, ao final do cal dexeneran. Porén, antes da súa desaparición, algunhas glándulas segregan moito máis do normal. Este fenómeno de hipersecreción denomínase fenómeno de Arias-Stella,[30] en honra do patólogo Javier Arias-Stella.
Glándulas uterinas
[editar | editar a fonte]
| Proteínas, glicoproteínas e péptidos
segregados polas glándulas uterinas[30] |
| Asociados á matriz: |
| Fibronectina |
| Laminina |
| Entactina |
| Coláxeno tipo IV |
| Heparán sulfato |
| Proteoglicano |
| Integrinas |
| – |
| Outros: |
| Mucinas |
| Prolactina |
| IGFBP-1 |
| Glicodelina |
| Proteína endometrial 15 |
| Albumina |
| Beta-lipoproteína |
| Relaxina |
| Factor de crecemento de fibroblastos 1 |
| Factor de crecemento de fibroblastos 2 |
| Pappalisina-1 |
| Proteína de resposta ao estrés 27 (SRP-27) |
| CA-125 |
| Beta-endorfina |
| Leu-encefalina |
| Diamino oxidase |
| Activador do plasminóxeno tisular |
| Renina |
| Anhidrase carbónica dependene da proxesterona |
| Lactoferrina |
O recubrimento interno do útero non só se transforma, senón que a secreción das glándulas uterinas cambia. Este cambio é inducido polo incremento no nivel de proxesterona producida polo corpo lúteo. A diana destas secrecións é o embrioblasto e exence varias funcións nel.
Nutrición
[editar | editar a fonte]O embrión pasa aproximadamente 72 horas na cavidade uterina antes de implantarse. Nese tempo non pode rcibir nutrición directamente do sangue materno e ten que depender dos nutrientes segregados á cavidade uterina, por exemplo, ferro e vitaminas liposolubles.[30]
Crecemento e implantación
[editar | editar a fonte]Ademais de secrecións para a nutrición, o endometrio segrega varias proteínas dependentes de esteroides, importantes para o crecemento e a implantación. Tamén se segregan colesterol e esteroides.[30] A implantación é ademais facilitada pola síntese de substancias da matriz, moléculas de adhesión celular e receptores de superficie para as substancias da matriz.
Importancia clínica
[editar | editar a fonte]Fallo na implantación
[editar | editar a fonte]A reprodución en humanos non é moi eficiente. Só arredor do 30% das concepcións naturais dan lugar a embarazos con éxito. Dos embarazos fracasados arredor do 85% débense a fallos na implantación.[48] Os fallos na implantación considérase que son causados por unha receptividade uterina inadecuada en dous terzos dos casos, e por problemas co propio embrión no outro terzo.[49] A maioría dos procedementos de FIV fracasan debido a fallos na implantación, que supoñen case a metade de todos os fallos no embarazo neste tipo de técnicas.[48]
A receptividade uterina inadecuada pode deberse a aormalidades nas citocinas e na sinalización hormonal ou a alteracións epixenéticas.[50] Os fallos recorrenes na implantación son causa de infertilidade feminina. Por tanto, as taxas de embarazo poden mellorarse optimiando a receptividade endometrial para a implantación.[50] A avaliación de marcadores da implantación pode axudar a predicir o resultado dun embarazo e detectar deficiencias na implantación ocultas.[50] Como parte dun programa de órgano nun chip desenvolveuse un "endometrio nun chip" como modelo do funcionamento do endometrio que podería identificar máis claramente as causas dos fallos na implantación.[51] Tamén se desenvolveron organoides para modelizar o endometrio e o seu papel na implantación.[52]
En mulleres con máis de tres fallos na implantación na reprodución asistida, unha revisión de varios pequenos estudos controlados aleatorizados estimou que o uso de heparina de baixo peso molecular adxunta mellora a taxa de nacementos vivos en aproximadamente o 80%.[53] O soporte da fase lútea pode incluír o uso de proxesterona e gonadotropina coriónica humana (hCG) para mellorar as posibilidades dunha implantación correcta.[54]
Deficiencia de cinc
[editar | editar a fonte]O cinc é crucial na preconcepción (e nun embarazo con éxito), e a súa deficiencia pode levar a un desenvolvemento incompetente do blastocisto. Unha vez que un ovocito se fecunda, libérase cinc nun chispazo de cinc que promove cambios que inclúen o endurecemento da zona pelúcida que impide a poliespermia.[55]
Hemorraxias na implantación
[editar | editar a fonte]As hemorraxias e o manchado son comúns durante a fase lútea do ciclo menstrual e etapas iniciais do embarazo, pero non están relacionados coa implantación. A hemorraxia na implantación ocorre entre os 7 e 14 días despois da fecundación,[56] e unha lixeira hemorraxia vaxinal pode ocorrer a inicios do embarazo debido á penetración do blastocisto no recubrinmento interno uterino durante a implantación.[57][58][59] No día 13 o sitio de penetración do embrión no endometrio xeralmente xa está pechado por un tapón de fibrina, pero o incremento do fluxo sanguíneo nos espazos do sincitiotrofoblasto pode ás veces causar unha hemorraxia nese sitio.[57] A hemorraxia na implantación pode ir acompañada de síntomas como cambras, náuseas, sensibilidade nos peitos e dores de cabeza.[60] A hemorraxia da implantación pode distinguirse da menstruación pola cor, coagulación, e a forza e duración do fluxo.[61][62]
Notas
[editar | editar a fonte]- ↑ "Definition of implantation". www.merriam-webster.com (en inglés). Consultado o 26 de abril de 2023.
- ↑ Niringiyumukiza JD, Cai H, Xiang W (maio de 2018). "Prostaglandin E2 involvement in mammalian female fertility: ovulation, fertilization, embryo development and early implantation". Reproductive Biology and Endocrinology 16 (1): 43. PMC 5928575. PMID 29716588. doi:10.1186/s12958-018-0359-5.
- ↑ 3,0 3,1 Wilcox AJ, Harmon Q, Doody K, Wolf DP, Adashi EY (abil de 2020). "Preimplantation loss of fertilized human ova: estimating the unobservable". Human Reproduction 35 (4): 743–750. PMC 8287936. PMID 32296829. doi:10.1093/humrep/deaa048.
- ↑ 4,0 4,1 Yang Y, Zhu QY, Liu JL (novembro de 2021). "Deciphering mouse uterine receptivity for embryo implantation at single-cell resolution". Cell Proliferation 54 (11): e13128. PMC 8560620. PMID 34558134. doi:10.1111/cpr.13128.
- ↑ 5,0 5,1 5,2 5,3 5,4 Ezechukwu HC, Diya CA, Shrestha N, Hryciw DH (setembro de 2020). "Role for endocannabinoids in early pregnancy: recent advances and the effects of cannabis use". American Journal of Physiology. Endocrinology and Metabolism 319 (3): E557–E561. PMID 32744098. doi:10.1152/ajpendo.00210.2020.
- ↑ Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C, Finazzi-Agrò A (2000). "Relation between decreased anandamide hydrolase concentrations in human lymphocytes and miscarriage". Lancet 355 (9212): 1326–9. PMID 10776746. doi:10.1016/S0140-6736(00)02115-2.
- ↑ Dennedy MC, Friel AM, Houlihan DD, Broderick VM, Smith T, Morrison JJ (xaneiro de 2004). "Cannabinoids and the human uterus during pregnancy" (PDF). American Journal of Obstetrics and Gynecology 190 (1): 2–9; discussion 3A. PMID 14749627. doi:10.1016/j.ajog.2003.07.013.
- ↑ 8,0 8,1 8,2 Imakawa K, Bai R, Fujiwara H, Kusama K (xaneiro de 2016). "Conceptus implantation and placentation: molecules related to epithelial-mesenchymal transition, lymphocyte homing, endogenous retroviruses, and exosomes". Reproductive Medicine and Biology 15 (1): 1–11. PMC 5715838. PMID 29259417. doi:10.1007/s12522-015-0215-7.
- ↑ 9,0 9,1 9,2 9,3 9,4 Kim SM, Kim JS (decembro de 2017). "A Review of Mechanisms of Implantation". Development & Reproduction 21 (4): 351–359. PMC 5769129. PMID 29359200. doi:10.12717/DR.2017.21.4.351.
- ↑ 10,0 10,1 McGowen MR, Erez O, Romero R, Wildman DE (2014). "The evolution of embryo implantation". The International Journal of Developmental Biology 58 (2–4): 155–161. PMC 6053685. PMID 25023681. doi:10.1387/ijdb.140020dw.
- ↑ 11,0 11,1 Moore KL (2020). The developing human: clinically oriented embryology (Eleventh ed.). Edinburgh. pp. 35–42. ISBN 978-0-323-61154-1.
- ↑ Cakmak H, Taylor HS (marzo de 2011). "Implantation failure: molecular mechanisms and clinical treatment". Human Reproduction Update 17 (2): 242–253. PMC 3039220. PMID 20729534. doi:10.1093/humupd/dmq037.
- ↑ Ochoa-Bernal MA, Fazleabas AT (marzo de 2020). "Physiologic Events of Embryo Implantation and Decidualization in Human and Non-Human Primates". International Journal of Molecular Sciences 21 (6): 1973. PMC 7139778. PMID 32183093. doi:10.3390/ijms21061973.
- ↑ 14,0 14,1 Gauster M, Moser G, Wernitznig S, Kupper N, Huppertz B (xuño de 2022). "Early human trophoblast development: from morphology to function". Cellular and Molecular Life Sciences 79 (6): 345. PMC 9167809. PMID 35661923. doi:10.1007/s00018-022-04377-0.
- ↑ Sadler TW (2010). Langman's medical embryology. (11ª ed.). Philadelphia: Lippincott William & Wilkins. p. 45. ISBN 9780781790697.
- ↑ Boron 2004, p. 1172.
- ↑ 17,0 17,1 17,2 Seshagiri PB, Vani V, Madhulika P (marzo de 2016). "Cytokines and Blastocyst Hatching". American Journal of Reproductive Immunology 75 (3): 208–17. PMID 26706391. doi:10.1111/aji.12464.
- ↑ IVF-infertility.com
- ↑ Singh H, Aplin JD (xulo de 2009). "Adhesion molecules in endometrial epithelium: tissue integrity and embryo implantation". Journal of Anatomy 215 (1): 3–13. PMC 2714633. PMID 19453302. doi:10.1111/j.1469-7580.2008.01034.x.
- ↑ Gipson IK, Blalock T, Tisdale A, Spurr-Michaud S, Allcorn S, Stavreus-Evers A, Gemzell K (xaneiro de 2008). "MUC16 is lost from the uterodome (pinopode) surface of the receptive human endometrium: in vitro evidence that MUC16 is a barrier to trophoblast adherence". Biology of Reproduction 78 (1): 134–142. PMID 17942799. doi:10.1095/biolreprod.106.058347.
- ↑ 21,0 21,1 Margarit L, Taylor A, Roberts MH, Hopkins L, Davies C, Brenton AG, et al. (decembro de 2010). "MUC1 as a discriminator between endometrium from fertile and infertile patients with PCOS and endometriosis". The Journal of Clinical Endocrinology and Metabolism 95 (12): 5320–5329. PMID 20826587. doi:10.1210/jc.2010-0603.
- ↑ Carson DD, Julian J, Lessey BA, Prakobphol A, Fisher SJ (setembro de 2006). "MUC1 is a scaffold for selectin ligands in the human uterus". Frontiers in Bioscience 11 (1): 2903–2908. PMID 16720361. doi:10.2741/2018.
- ↑ Francis LW, Yao SN, Powell LC, Griffiths S, Berquand A, Piasecki T, et al. (febreiro de 2021). "Highly glycosylated MUC1 mediates high affinity L-selectin binding at the human endometrial surface". Journal of Nanobiotechnology 19 (1): 50. PMC 7890821. PMID 33596915. doi:10.1186/s12951-021-00793-9.
- ↑ Genbacev OD, Prakobphol A, Foulk RA, Krtolica AR, Ilic D, Singer MS, et al. (xaneiro de 2003). "Trophoblast L-selectin-mediated adhesion at the maternal-fetal interface". Science 299 (5605): 405–408. Bibcode:2003Sci...299..405G. PMID 12532021. doi:10.1126/science.1079546.
- ↑ Zhu JY, Pang ZJ, Yu YH (2012). "Regulation of trophoblast invasion: the role of matrix metalloproteinases". Reviews in Obstetrics & Gynecology 5 (3–4): e137–e143. PMC 3594863. PMID 23483768.
- ↑ Carter AM, Enders AC, Pijnenborg R (marzo de 2015). "The role of invasive trophoblast in implantation and placentation of primates". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 370 (1663): 20140070. PMC 4305171. PMID 25602074. doi:10.1098/rstb.2014.0070.
- ↑ 27,0 27,1 Zare F, Seifati SM, Dehghan-Manshadi M, Fesahat F (maio de 2020). "Preimplantation Factor (PIF): a peptide with various functions". JBRA Assist Reprod 24 (2): 214–218. PMC 7169918. PMID 32202400. doi:10.5935/1518-0557.20190082.
- ↑ Gardiner C, Tannetta DS, Simms CA, Harrison P, Redman CW, Sargent IL (2011). "Syncytiotrophoblast microvesicles released from pre-eclampsia placentae exhibit increased tissue factor activity". PLOS ONE 6 (10): e26313. Bibcode:2011PLoSO...626313G. PMC 3194796. PMID 22022598. doi:10.1371/journal.pone.0026313.
- ↑ Cindrova-Davies, Tereza; Sferruzzi-Perri, Amanda N. (1 de novembro de 2022). "Human placental development and function". Seminars in Cell & Developmental Biology 131: 66–77. doi:10.1016/j.semcdb.2022.03.039. Consultado o 13 de outubro de 2023.
- ↑ 30,00 30,01 30,02 30,03 30,04 30,05 30,06 30,07 30,08 30,09 30,10 30,11 30,12 30,13 30,14 30,15 30,16 30,17 30,18 30,19 30,20 Boron W, Boulpaep E (2004). Medical Physiology: A Cellular And Molecular Approaoch. Oxford: Elsevier. ISBN 1-4160-2328-3. OCLC 61527528. Erro no estilo Vancouver: wikilink (Axuda)
- ↑ Moser G, Weiss G, Sundl M, Gauster M, Siwetz M, Lang-Olip I, Huppertz B (marzo de 2017). "Extravillous trophoblasts invade more than uterine arteries: evidence for the invasion of uterine veins". Histochemistry and Cell Biology 147 (3): 353–366. PMC 5344955. PMID 27774579. doi:10.1007/s00418-016-1509-5.
- ↑ Dawe GS, Tan XW, Xiao ZC (xaneiro de 2007). "Cell migration from baby to mother". Cell Adhesion & Migration 1 (1): 19–27. PMC 2633676. PMID 19262088. doi:10.4161/cam.4082.
- ↑ 33,0 33,1 33,2 Hennes A, Devroe J, De Clercq K, Ciprietti M, Held K, Luyten K, Van Ranst N, Maenhoudt N, Peeraer K, Vankelecom H, Voets T, Vriens J (abril de 2023). "Protease secretions by the invading blastocyst induce calcium oscillations in endometrial epithelial cells via the protease-activated receptor 2". Reprod Biol Endocrinol 21 (1): 37. PMC 10105462. PMID 37060079. doi:10.1186/s12958-023-01085-7.
- ↑ Murphy CR (agostode 2004). "Uterine receptivity and the plasma membrane transformation". Cell Research 14 (4): 259–267. PMID 15353123. doi:10.1038/sj.cr.7290227.
- ↑ Murphy CR, Shaw TJ (decembro de 1994). "Plasma membrane transformation: a common response of uterine epithelial cells during the peri-implantation period". Cell Biology International 18 (12): 1115–1128. PMID 7703952. doi:10.1006/cbir.1994.1038.
- ↑ Teh WT, McBain J, Rogers P (novembro de 2016). "What is the contribution of embryo-endometrial asynchrony to implantation failure?". Journal of Assisted Reproduction and Genetics 33 (11): 1419–1430. PMC 5125144. PMID 27480540. doi:10.1007/s10815-016-0773-6.
- ↑ Sternberg AK, Buck VU, Classen-Linke I, Leube RE (agosto de 2021). "How Mechanical Forces Change the Human Endometrium during the Menstrual Cycle in Preparation for Embryo Implantation". Cells 10 (8): 2008. PMC 8391722. PMID 34440776. doi:10.3390/cells10082008.
- ↑ Wu HM, Chen LH, Hsu LT, Lai CH (novembro de 2022). "Immune Tolerance of Embryo Implantation and Pregnancy: The Role of Human Decidual Stromal Cell- and Embryonic-Derived Extracellular Vesicles". Int J Mol Sci 23 (21): 13382. PMC 9658721. PMID 36362169. doi:10.3390/ijms232113382.
- ↑ Liang J, Wang S, Wang Z (novembro de 2017). "Role of microRNAs in embryo implantation". Reprod Biol Endocrinol 15 (1): 90. PMC 5699189. PMID 29162091. doi:10.1186/s12958-017-0309-7.
- ↑ Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C, Finazzi-Agrò A (2000). "Relation between decreased anandamide hydrolase concentrations in human lymphocytes and miscarriage". Lancet 355 (9212): 1326–9. PMID 10776746. doi:10.1016/S0140-6736(00)02115-2.
- ↑ 41,0 41,1 41,2 41,3 41,4 Quinn KE, Matson BC, Wetendorf M, Caron KM (febreiro de 2020). "Pinopodes: Recent advancements, current perspectives, and future directions". Molecular and Cellular Endocrinology 501: 110644. PMC 6962535. PMID 31738970. doi:10.1016/j.mce.2019.110644.
- ↑ Xiao Y, Sun X, Yang X, Zhang J, Xue Q, Cai B, Zhou Y (xuño de 2010). "Leukemia inhibitory factor is dysregulated in the endometrium and uterine flushing fluid of patients with adenomyosis during implantation window". Fertility and Sterility 94 (1): 85–89. PMID 19361790. doi:10.1016/j.fertnstert.2009.03.012.
- ↑ Ng SW, Norwitz GA, Pavlicev M, Tilburgs T, Simón C, Norwitz ER (xuño de 2020). "Endometrial Decidualization: The Primary Driver of Pregnancy Health". Int J Mol Sci 21 (11): 4092. PMC 7312091. PMID 32521725. doi:10.3390/ijms21114092.
- ↑ Crha I, Ventruba P, Žáková J, Ješeta M, Pilka R, Lousová E, Papíková Z (2019). "Uterine microbiome and endometrial receptivity". Ceska Gynekologie 84 (1): 49–54. PMID 31213058.
- ↑ Moreno I, Codoñer FM, Vilella F, Valbuena D, Martinez-Blanch JF, Jimenez-Almazán J, et al. (decembro de 2016). "Evidence that the endometrial microbiota has an effect on implantation success or failure". American Journal of Obstetrics and Gynecology 215 (6): 684–703. PMID 27717732. doi:10.1016/j.ajog.2016.09.075.
- ↑ 46,0 46,1 46,2 Zhao Y, He D, Zeng H, Luo J, Yang S, Chen J, Abdullah RK, Liu N (setembro de 2021). "Expression and significance of miR-30d-5p and SOCS1 in patients with recurrent implantation failure during implantation window". Reprod Biol Endocrinol 19 (1): 138. PMC 8425163. PMID 34496883. doi:10.1186/s12958-021-00820-2.
- ↑ Ruan YC, Guo JH, Liu X, Zhang R, Tsang LL, Dong JD, et al. (xullo de 2012). "Activation of the epithelial Na+ channel triggers prostaglandin E₂ release and production required for embryo implantation". Nature Medicine 18 (7): 1112–1117. PMID 22729284. doi:10.1038/nm.2771.
- ↑ 48,0 48,1 Wang Y, Jiang X, Jia L, Wu X, Wu H, Wang Y, et al. (2022). "A Single-Cell Characterization of Human Post-implantation Embryos Cultured In Vitro Delineates Morphogenesis in Primary Syncytialization". Frontiers in Cell and Developmental Biology 10: 835445. PMC 9240912. PMID 35784461. doi:10.3389/fcell.2022.835445.
- ↑ Melford SE, Taylor AH, Konje JC (2013). "Of mice and (wo)men: factors influencing successful implantation including endocannabinoids". Human Reproduction Update 20 (3): 415–428. PMID 24306146. doi:10.1093/humupd/dmt060.
- ↑ 50,0 50,1 50,2 Cakmak H, Taylor HS (2010). "Implantation failure: molecular mechanisms and clinical treatment". Human Reproduction Update 17 (2): 242–253. PMC 3039220. PMID 20729534. doi:10.1093/humupd/dmq037.
- ↑ Ahn J, Yoon MJ, Hong SH, Cha H, Lee D, Koo HS, et al. (setembro de 2021). "Three-dimensional microengineered vascularised endometrium-on-a-chip". Human Reproduction 36 (10): 2720–2731. PMC 8450871. PMID 34363466. doi:10.1093/humrep/deab186.
- ↑ Rawlings TM, Makwana K, Tryfonos M, Lucas ES (xullo de 2021). "Organoids to model the endometrium: implantation and beyond". Reprod Fertil 2 (3): R85–R101. PMC 8801025. PMID 35118399. doi:10.1530/RAF-21-0023.
- ↑ Potdar N, Gelbaya TA, Konje JC, Nardo LG (2013). "Adjunct low-molecular-weight heparin to improve live birth rate after recurrent implantation failure: a systematic review and meta-analysis". Human Reproduction Update 19 (6): 674–684. PMID 23912476. doi:10.1093/humupd/dmt032.
- ↑ Farquhar C, Marjoribanks J (agosto de 2018). "Assisted reproductive technology: an overview of Cochrane Reviews". The Cochrane Database of Systematic Reviews 2018 (8): CD010537. PMC 6953328. PMID 30117155. doi:10.1002/14651858.CD010537.pub5.
- ↑ Garner TB, Hester JM, Carothers A, Diaz FJ (maio de 2021). "Role of zinc in female reproduction". Biology of Reproduction 104 (5): 976–994. PMC 8599883. PMID 33598687. doi:10.1093/biolre/ioab023.
- ↑ "Implantation Bleeding vs A Period: How To Tell The Difference". ReUnite Rx (en inglés). 2020-12-09. Consultado o 2021-07-29.
- ↑ 57,0 57,1 Sadler TW (2010). Langman's medical embryology. (11ª ed.). Philadelphia: Lippincott William & Wilkins. pp. 50–51. ISBN 9780781790697.
- ↑ Sheiner E (2011). Bleeding during pregnancy a comprehensive guide. New York: Springer. p. 9. ISBN 978-1-441-99810-1.
- ↑ Harville EW, Wilcox AJ, Baird DD, Weinberg CR (setembro de 2003). "Vaginal bleeding in very early pregnancy". Human Reproduction 18 (9): 1944–1947. PMID 12923154. doi:10.1093/humrep/deg379.
- ↑ Heger, L. Demosthenes E, ed. "What do implantation cramps feel like? How to tell the difference between implantation and menstrual cramping". Insider (en inglés). Consultado o 2021-07-29.
- ↑ Aggarwal K (2020). "Vaginal Bleeding in Early Pregnancy". En Sharma A. Labour Room Emergencies (en inglés). Singapore: Springer. pp. 155–161. ISBN 978-981-10-4953-8. doi:10.1007/978-981-10-4953-8_18.
- ↑ "How Do I Know if It's Implantation Bleeding?". MedicineNet (en inglés). Consultado o 2021-07-29.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Boron W, Boulpaep E (2004). Medical Physiology: A Cellular And Molecular Approaoch. Oxford: Elsevier. ISBN 1-4160-2328-3. OCLC 61527528. Erro no estilo Vancouver: wikilink (Axuda)
