Colesterol
| Colesterol | |
|---|---|
 | |
 | |
(3β)-colest-5-en-3-ol | |
2,15-dimetil-14-(1,5-dimetilhexil)tetraciclo[8.7.0.02,7.011,15]heptacos-7-en-5-ol | |
Outros nomes (10R,13R)-10,13-dimetil-17-(6-metilheptan-2-il)-2,3,4,7,8,9,11,12,14,15,16,17-dodecahidro-1H-ciclopenta[a]fenantren-3-ol, Colesterina, Colesteril alcohol | |
| Identificadores | |
| Número CAS | 57-88-5 |
| PubChem | 5997 |
| ChemSpider | 5775 |
| UNII | 97C5T2UQ7J |
| KEGG | D00040 |
| ChEBI | CHEBI:16113 |
| ChEMBL | CHEMBL112570 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C27H46O |
| Masa molecular | 386,65 g/mol |
| Aspecto | pos cristalinos brancos[1] |
| Densidade | 1,052 g/cm3 |
| Punto de fusión | 148–150 °C[1] |
| Punto de ebulición | 360 °C (descomponse) |
| Solubilidade en auga | 0,095 mg/L (30 °C) |
| Solubilidade | soluble en acetona, benceno, cloroformo, etanol, éter, hexano, isopropil miristato, metanol |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O colesterol (do grego chole-, bile, e stereos, sólido, e co sufixo químico -ol de alcohol), é un lípido esteroide do grupo dos esterois,[2] que se biosintetiza de forma natural e é necesario para o organismo e beneficioso en cantidades normais, pero que en exceso é prexudicial para a saúde. O exceso de colesterol no torrente sanguíneo provoca que se deposite en forma de placas nas arterias. As placas provocan a arteriosclerose e o conseguinte estreitamento das arterias. Se a arteria que se obstrúe pertence o sistema coronario do corazón que rega as paredes do corazón producirase un infarto de miocardio. O colesterol é biosintetizado por practicamente todas as células animais, xa que é un compoñente esencial na estrutura das súas membranas celulares (pero non nas das bacterias e só aparece en pequenas cantidades nas das plantas), xa que mantén a integridade estrutural da membrana e a súa fluidez. Ademais, do colesterol derivan importantes substancias metabólicas, como as hormonas esteroides, ácidos biliares, e a vitamina D.[3] O colesterol é o principal esterol sintetizado polos animais. Practicamente todos os tipos de células animais o producen. En vertebrados as células hepáticas producen maiores cantidades que outras células, e tamén abunda nos tecidos cerebrais e pancreáticos e na medula espiñal. Está case ausente en procariotas (bacterias e arqueas), aínda que hai algunhas excepcións, como os Mycoplasma, que necesitan colesterol para crecer.[4] Nas plantas tamén está presente, pero é máis escaso.
François Poulletier de la Salle foi o primeiro que identificou o colesterol en forma sólida en cálculos biliares en 1769. Porén, non se lle deu nome ata que en 1815 Michel Eugène Chevreul o denominou colesterina.[5][6]
Estrutura química
[editar | editar a fonte]A fórmula química do colesterol pode representarse de dúas formas: C27H46O / C27H45OH.
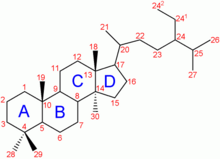


É un lípido esteroide, que ten a estrutura do ciclopentanoperhidrofenantreno (ou esterano), constituída por catro aneis fusionados, denominados A, B, C e D, que presentan varias substitucións:
- Dous grupos metilo nas posicións C-10 e C-13.
- Unha cadea alifática ramificada hidrocarbonada de 8 carbonos que colga da posición C-17.
- Un grupo hidroxilo na posición C-3, que é a única parte hidrófila da molécula.
- Un dobre enlace entre os carbonos C-5 e C-6 (segundo anel).
A molécula de colesterol é anfipática, xa que ten unha parte polar (o grupo OH) e unha parte non polar ou hidrófoba (os aneis e a cadea hidrocarbonada, é dicir, o resto da molécula). Isto permite que se oriente nas membranas co grupo OH orientado cara á parte hidrófila da membrana (partes externas) e a parte hidrófoba da molécula inserida no interior da membrana (parte hidrófoba da membrana). O colesterol libre en auga é moi insoluble (solubilidade de 10−8 M), pero é bastante soluble en disolventes apolares como o cloroformo (CHCl3).
Estereoisómeros
[editar | editar a fonte]O colesterol ten 256 estereoisómeros que se orixinan nos seus 8 estereocentros, aínda que só dous dos estereoisómeros teñen importancia bioquímica, que son o nat-colesterol e o ent-colesterol (os prefixos significan natural e enantiómero, respectivamente),[7][8] e só aparece na natureza o nat-colesterol.
Colesterol "bo" e "malo"
[editar | editar a fonte]Desde un punto de vista químico non hai ningunha diferenza entre eles; son moléculas idénticas. A distinción é fisiolóxica. O colesterol é transportado polo sangue dentro dunhas partículas globulares chamadas lipoproteínas, que as hai de varias clases. O colesterol transportado nas lipoproteínas LDL tende a depositarse nas arterias en certas situacións, polo que é malo para a saúde, e por iso se denomina colesterol "malo". O que é transportado polas lipoproteínas HDL tende a dirixirse ao fígado, onde é destruído, polo que ese é o colesterol "bo".
Fisioloxía
[editar | editar a fonte]Como o colesterol é moi importante para os animais, practicamente todas as células o sintetizan mediante un complexo proceso que comeza coa vía do mevalonato e acaba cunha conversión en 19 pasos do lanosterol en colesterol.
Estímase que un home (macho) de 68 kg sintetiza normalmente 1 g de colesterol diario, e o seu corpo contén uns 35 g, a maioría nas membranas celulares. Pero en moitos países occidentais o colesterol que se toma na dieta excede os límites recomendados.[9]
A maior parte do colesterol inxerido está esterificado (cun ácido graxo enlazado ao seu grupo OH), e o colesterol esterificado absórbese mal no intestino. Cando hai unha absorción de colesterol adicional no intestino, o corpo compénsaa reducindo a síntese de colesterol nas células.[10] Debido a isto, de sete a dez horas despois da inxestión, o colesterol produce pouco ou ningún efecto sobre o contido de colesterol corporal total ou as concentracións de colesterol no sangue. Porén, durante as primeiras sete horas despois da inxestión de colesterol, os niveis increméntanse significativamente.[11]
O colesterol recíclase no corpo. O fígado excrétao en forma non esterificada pola bile ao tracto dixestivo. Xeralmente, un 50% do colesterol excretado na bile é reabsorbido no intestino delgado e devolto ao sangue.
As plantas fabrican tamén colesterol, pero en cantidades moito menores que os animais (mentres que a media da porcentaxe de colesterol no total de lípidos nas plantas é duns 50 mg/kg de lípidos, nos animais é de 5 g/kg ou máis).[12][13] As plantas conteñen colesterol libre e esterificado. O colesterol aparece nas membranas e nos lipidos de superficie das follas. Ademais as plantas conteñen máis de 250 esteroides (o sitosterol é o máis abondoso)[12]. As plantas fabrican fitosterois (substancias quimicamente similares ao colesterol), que compiten no intestino co colesterol pola absorción, polo que reducen potencialmente a absorción de colesterol.[14] Cando as células da mucosa intestinal absorben os fitosterois en vez de colesterol, despois normalmente excretan os fitosterois de novo ao tracto intestinal, o que é un importante mecanismo de protección.
Nas membranas bacterianas non hai colesterol, pero si unhas substancias parecidas chamadas hopanoides.[15]

Función
[editar | editar a fonte]O colesterol é un compoñente necesario para formar e manter as membranas celulares; modula a fluidez das membranas no intervalo fisiolóxico de temperaturas. O colesterol actúa como un regulador bidireccional da fluidez da membrana porque a altas temperaturas estabiliza a membrana e eleva o seu punto de fusión, mentres que a baixas temperaturas se intercala entre os fosfolípidos e impide que estes se agrupen e se fagan máis ríxidos. O grupo hidroxilo (OH) do colesterol interacciona coas cabezas polares dos fosfolípidos e esfingolípidos da bicapa lipídica, mentres que o voluminoso esqueleto cíclico de esteroide e a cadea lateral hidrocarbonada están orientados e introducidos na parte hidrófoba central da membrana, xunto coas colas hidrófobas dos outros lípidos. Ao interaccionar coas cadeas de ácidos graxos dos fosfolípidos, o colesterol modifica o empaquetamento da membrana, o cal altera a fluidez da membrana.[16] A estrutura do anel tetracíclico do colesterol contribúe a facer descender a fluidez da membrana, xa que a molécula está nunha conformación trans, que fai que toda a molécula do colesterol menos a cadea lateral sexa ríxida e plana.[17] Neste papel estrutural, o colesterol reduce a permeabilidade da membrana plasmática a solutos neutros,[18] ións hidróxeno, e ións sodio.[19]
Nas membranas o colesterol tamén funciona no transporte intracelular, sinaliación celular e condución nerviosa. O colesterol é esencial para manter a estrutura e a función das caveolas invaxinadas e as depresións cubertas de clatrina, que interveñen na endocitose dependente de caveolas e dependente de clatrina. O papel do colesterol nesta endocitose pode investigarse usando metil beta ciclodextrina (MβCD), que retira o colesterol da membrana plasmática. Recentes estudos indicaron que o colesterol está tamén implicado en procesos de sinalización celular ao axudar a formar balsas lipídicas na membrana plasmática. A formación de balsas lipídicas xunta proteínas receptoras en estreita proximidade con altas concentracións de moléculas de segundo mensaxeiro.[20] Moitas neuronas teñen unha vaíña de mielina, rica en colesterol, derivada de capas compactadas de membrana de células de Schwann, que proporciona illamento eléctrico para que a condución dos impulsos eléctricos sexa máis eficaz.[21]
Nas células, o colesterol é a molécula precursora de varias vías bioquímicas. No fígado, o colesterol convértese nos ácidos biliares da bile, a cal é despois almacenada na vesícula biliar. Os ácidos biliares solubilizan as graxas no tracto dixestivo, o que axuda a que estas sexan dixeridas e absorbidas, xunto con vitaminas liposolubles como as vitaminas A, D, E, e K. O colesterol é un importante precursor para a síntese de vitamina D e de hormonas esteroides, como as producidas nas glándulas adrenais (cortisol e aldosterona) ou as hormonas sexuais (proxesterona, estróxenos e testosterona) e os seus derivados.[3]
Algunhas investigacións indican que o colesterol pode actuar como un antioxidante.[22]
Biosíntese
[editar | editar a fonte]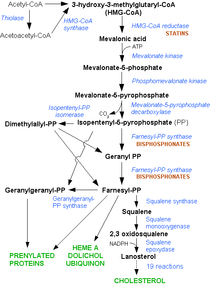
Todas as células animais sintetizan colesterol para o seu uso propio, pero a cantidade producida varía dun tipo de célula ou de órgano a outro. Aproximadamente o 20–25% da produción diaria de colesterol ocorre no fígado; outros sitios de moita síntese son os intestinos, glándulas adrenais, e órganos reprodutores.
A biosíntese do colesterol ten lugar no retículo endoplasmático liso de practicamente todas as células dos animais vertebrados. Mediante estudos de marcaxe isotópica, Rittenberg e Bloch demostraron que todos os átomos de carbono do colesterol proceden, en última instancia, do acetato, en forma de acetil coencima A (acetil-CoA). Foron necesarios outros 30 anos de investigación para conseguir describir as liñas xerais da biosíntese do colesterol, e aínda hoxe se descoñecen moitos detalles encimáticos e mecanísticos da ruta.
A síntese no corpo empeza coa vía do mevalonato na que dúas moléculas de acetil-CoA condensan para formar acetoacetil-CoA. Despois hai unha segunda condensación entre o acetoacetil-CoA e outra molécula de acetil-CoA para formar 3-hidroxi-3-metilglutaril-CoA (HMG-CoA).[23] Esta molécula é despois reducida a mevalonato polo encima HMG-CoA redutase. A produción de mevalonato é o paso limitante e irreversible da ruta e é o punto onde actúan os medicamentos estatinas (un tipo de fármacos usados para reducir o colesterol corporal).
O mevalonato convértese finalmente en isopentenil pirofosfato (IPP) por medio de dous pasos de fosforilación e unha descarboxilación que require ATP. Seguidamente, tres moléculas de isopentenil pirofosfato condensan para formar farnesil pirofosfato pola acción do encima xeranil transferase. Dúas moléculas de farnesil pirofosfato condensan formando escualeno pola acción da escualeno sintase no retículo endoplasmático.[23] A oxidoescualeno ciclase cicla o escualeno para formar lanosterol, que, por tanto, é a primeira molécula cíclica de toda a ruta. Finalmente, o lanosterol convértese en colesterol nun proceso que require 19 pasos.[24][25]
Konrad Bloch e Feodor Lynen compartiron o Premio Nobel de Medicina en 1964 polos seus descubrimentos sobre os mecanismos e regulación do colesterol e o metabolismo de ácidos graxos.
Velaquí unha táboa que resume os pasos da ruta de síntese do colesterol:
Regulación da síntese do colesterol
[editar | editar a fonte]
A biosíntese do colesterol está regulada directamente polos niveis presentes de colesterol, aínda que os mecanismos homeostáticos implicados só se coñecen en parte. Un maior consumo de colesterol procedente dos alimentos leva a un descenso neto da produción endóxena, mentres que unha menor inxesta de colesterol na dieta ten o efecto contrario. O principal mecanismo regulador é a percepción da cantidade de colesterol intracelular no retículo endoplasmático realizada polas proteínas SREBP 1 e 2 (sterol regulatory element-binding protein, proteína de unión ao elemento regulador de esterois).[26] En presenza de colesterol, a SREBP está unida a outras dúas proteínas: SCAP (SREBP cleavage-activating protein, proteína activadora da clivaxe de SERBP) e INSIG-1 (proteína do xene inducido por insulina 1). Cando baixan os niveis de colesterol, INSIG-1 disóciase do complexo SREBP-SCAP, o que permite que o complexo migre ao aparato de Golgi. Alí, a SREBP é clivada por S1P e S2P (protease do sitio 1 e protease do sitio 2), que son dous encimas que son activados por SCAP cando os niveis de colesterol son baixos.
A SREBP clivada migra despois ao núcleo celular, e actúa como un factor de transcrición para unirse ao elemento regulador de esterol (SRE), o cal estimula a transcrición de moitos xenes. Entre estes están o do receptor da lipoproteína de baixa densidade (LDL) e o da HMG-CoA redutase. O receptor de LDL capta as LDL circulantes no sangue, mentres que a HMG-CoA redutase produce un incremento da produción endóxena de colesterol.[27] Unha gran parte desta vía de sinalización foi esclarecida polos Drs. Michael S. Brown e Joseph L. Goldstein na década de 1970. En 1985, ambos os dous recibiron o Premio Nobel de Fisioloxía ou Medicina polos seus descubrimentos. Os seus seguintes traballos mostraron como a vía da SREBP regula a expresión de moitos xenes que controlan a formación de lípidos e o metabolismo e a distribución da enerxía corporal.
A síntese de colesterol pode tamén ser desactivada cando os niveis de colesterol son altos. A HMG-CoA redutase contén un dominio citosólico (responsable da súa función catalítica) e un dominio de membrana. O dominio de membrana percibe sinais para a súa propia degradación. O incremento da concentración de colesterol (e outros esterois) causa un cambio no estado de oligomerización deste dominio, o que o fai máis susceptible á destrución polo proteosoma. Esta actividade do encima pode tamén ser reducida por fosforilación por unha proteína quinase activada por AMP. Como esta quinase é activada polo AMP, que se produce cando se hidroliza o ATP, o resultado é que se detén a síntese de colesterol cando os niveis de ATP son baixos.[28]
Transporte polo plasma e regulación da absorción
[editar | editar a fonte]
O colesterol é moi pouco soluble en auga; só se disolve na auga do plasma sanguíneo en concentracións extremadamente pequenas. Para solucionar este problema, en vez de transportarse disolto directamente, o colesterol transpórtase no interior de lipoproteínas, que son complexos de partículas esferoidais cunha parte exterior onde están as partes hidrófilas de proteínas e lípidos anfipáticos, e na súa parte interior, lonxe do contacto coa auga, están os lípidos hidrófobos (entre eles os ésteres do colesterol) e as partes hidrófobas das proteínas e lípidos anfipáticos. Na parte interna transpórtanse triglicéridos e ésteres do colesterol. Na capa externa da lipoproteína están os fosfolípidos e o colesterol "libre" (non esterificado), coas cabezas polares dos fosfolípidos e o grupo OH do colesterol orientados cara ao exterior. O colesterol transportado nas lipoproteínas pode ser colesterol "libre" (co grupo OH libre) ou colesterol esterificado formando ésteres do colesterol (cun ácido graxo esterificando o OH).
No sangue hai varios tipos de lipoproteínas. En orde crecente de densidades, as lipoproteínas son: quilomicrons, lipoproteína de moi baixa densidade (VLDL), lipoproteína de baixa densidade (LDL), lipoproteína de densidade intermedia (IDL), e lipoproteína de alta densidade (HDL). As proporcións baixas proteína/lípido son típicas das lipoproteínas menos densas.
As lipoproteínas conteñen apolipoproteínas, que se unen a receptores específicos da membrana das células, dirixindo o seu cargamento lipídico a tecidos específicos. As partículas lipoproteicas, segundo a apolipoproteína que leven, están destinadas a un tecido ou outro, o que determina o punto de chegada e de saída do transporte do colesterol.
Os quilomicrons son as lipoproteínas menos densas, conteñen apolipoproteína B48, apolipoproteína C, e apolipoproteína E. Transportan as graxas desde o intestino (lípidos da dieta) ao músculo e outros tecidos que necesitan ácidos graxos para a produción de enerxía ou graxas. O colesterol que non se usa permanece nas restantes partículas de quilomicrons ricas en colesterol, e son transportadas por vía sanguínea ao fígado.
As partículas VLDL prodúcense no fígado a partir de triglicéridos e do colesterol que non foi utilizado para sintetizar ácidos biliares. Estas lipoproteínas conteñen apolipoproteína B100 e apolipoproteína E, e son degradadas pola lipoproteína lipase da parede dos vasos sanguíneos a IDL. As células das paredes dos vasos sanguíneos clivan e absorben os triglicéridos das IDL, o que incrementa a concentración de colesterol destas. As IDL son despois consumidas en dous procesos: a metade delas metabolízaa o encima HTGL e é captada polo receptor de LDL da superficie das células hepáticas, mentres que a outra metade continúa perdendo máis triglicéridos mentres circula polo sangue ata converterse en partículas LDL, que son as que teñen a máxima concentración de colesterol no seu interior.
As partículas LDL son as principais transportadoras de colesterol. Cada unha contén aproximadamente 1.500 moléculas de ésteres de colesterol. As LDL conteñen unha soa molécula de apolipoproteína B100, que é recoñecida polo receptor de LDL dos tecidos periféricos. A unión da apolipoproteína B100 ao receptor, provoca que se concentren moitos receptores LDL en depresións revestidas de clatrina da membrana das células. Seguidamente, fórmanse vesículas que conteñén o receptor e a LDL, que se introducen na célula por endocitose mediada por receptor. Estas vesículas acaban fusionándose cun lisosoma, e o encima lipase ácida lisosómica hidroliza os ésteres do colesterol. O colesterol pode despois utilizarse en biosínteses ou ser esterificado e almacenado na célula, para que non interfira coas membranas.
Os receptores de LDL que se consomen durante a absorción de colesterol son recuperados porque unha parte se recicla (as vesículas de endocitose baleiras volven á membrana) e outra parte se sintetiza de novo. A súa síntese é regulada pola SREBP, a mesma proteína que controla a síntese de novo de colesterol, segundo a súa presenza en maior ou menor cantidade na célula. Unha célula con abundante colesterol bloquea a súa síntese de receptor de LDL, para impedir que se capte máis colesterol traído polas LDL. Inversamente, hai síntese de receptor de LDL cando a célula é deficiente en colesterol.
Cando este proceso deixa de estar regulado, as partículas LDL que non encontran receptores empezan a acumularse no sangue. Estas LDL son oxidadas e fagocitadas polos macrófagos, que acaban ateigados delas e convértense en células escumosas. As células escumosas a miúdo quedan atrapadas nas paredes dos vasos sanguíneos e contribúen á formación de placas ateroscleróticas. As diferenzas na homeostase do colesterol afectan ao desenvolvemento da aterosclerose temperá (engrosamento da capa íntima-media de arterias como as carótides).[29] Estas placas son a causa principal dos ataques ao corazón, apoplexías e outros problemas médicos graves, o que fai que o colesterol LDL (o chamado informalmente colesterol "malo") estea asociado con ditas doenzas.[28]
As partículas de lipoproteínas HDL transportan o colesterol de volta ao fígado, xa sexa para a súa excreción ou para enviar a outros tecidos que sintetizan hormonas, nun proceso chamado transporte de colesterol inverso.[30] Ter unha abundancia de HDL correlaciónase cun mellor estado de saúde, polo que o colesterol HDL denomínase colesterol "bo",[31] mentres que unha baixa cantidade de HDL está asociado coa progresión de enfermidade ateromatosa nas arterias.
Metabolismo, reciclaxe e excreción
[editar | editar a fonte]
O colesterol é susceptible á oxidación e forma facilmente derivados oxixenados chamados oxisterois. Os oxisterois poden orixinarse por tres mecanismos: autooxidación, oxidación secundaria á peroxidación de lípidos, oxidación por encimas que metabolizan o colesterol. Os oxisterois espertaron grande interese cando se viu que exercían accións inhibidoras sobre a biosíntese do colesterol,[32] o que se denominou “hipótese do oxisterol”. Outras funcións dos oxisterois na fisioloxía humana son: participación na biosíntese de ácidos biliares, funcionamento como formas de transporte do colesterol, e regulación da transcrición xenética.[33]
En experimentos bioquímicos utilízanse formas do colesterol con marcaxe radioactiva, como o colesterol tritiado. Estes derivados sofren degradación despois do seu almacenamento e son esenciais para purificar o colesterol antes do seu uso. O colesterol pode purificarse usando pequenas columnas de Sephadex LH-20.[34]
O colesterol é oxidado polo fígado orixinando varios ácidos biliares.[35] Estes, á súa vez, son conxugados con glicina, taurina, ácido glicurónico, ou sulfato. O fígado excreta á bile unha mestura de ácidos biliares conxgados e non conxugados, xunto co propio colesterol. Aproximadamente o 95% dos ácidos biliares son reabsorbidos nos intestinos, e os restantes son eliminados coas feces.[36] A excreción e reabsorción de ácidos biliares é a base da circulación enterohepática, que é esencial para a dixestión e absorción das graxas da dieta. En certas circunstancias, cando está máis concentrado, como ocorre na vesícula biliar, o colesterol pode cristalizar e é o principal constituínte da maioría dos cálculos biliares, pero poden formarse tamén menos frecuentemente cálculos de lecitina e bilirrubina.[37] Diariamente, entra no colon ata 1 g de colesterol. Este colesterol orixínase a partir da dieta, da bile e de células desescamadas do intestino, e pode ser metabolizado polas bacterias do colon. O colesterol convértese principalmente en coprostanol, un esterol non absorbible que se excreta nas feces.[38] Nun estudo illouse de feces humanas un colesterol reducido polas bacterias.[39]
Aínda que o colesterol é un esteroide asociado xeralmente con mamíferos, o microorganismo patóxeno humano Mycobacterium tuberculosis pode degradar completamente esta molécula e contén unha gran cantidade de xenes que están reguladas pola súa presenza.[40] Moitos destes xenes regulados polo colesterol son homólogos de xenes para a β-oxidación de ácidos graxos, pero eviolucionaron de maneira que se unen a grandes substratos esteroides como o colesterol.[41][42]
Fontes de colesterol
[editar | editar a fonte]Os organismos mamíferos obteñen colesterol a través de dúas vías:
- Vía exóxena ou absorción de colesterol contido nos alimentos. O colesterol encóntrase esencialmente nos alimentos de orixe animal (as plantas teñen moi pouco), maioritariamente a xema de ovo, fígado, lácteos, cerebro (miolos) e músculo esquelético (carnes vermellas).
- Vía endóxena ou síntese de novo, é a síntese de colesterol nas células animais a partir do seu precursor, o acetato, na súa forma activada acetil coencima A.
Fontes na dieta
[editar | editar a fonte]As graxas animais son mesturas complexas de triglicéridos e cantidades menores de fosfolípidos e colesterol. Como consecuencia, todos os alimentos que conteñen graxas animais conteñen colesterol en maior ou menor cantidade.[43] As fontes principais de colesterol na dieta son o queixo, xema de ovo, carne de vaca, carne de porco, carne de ave, peixe, e gambas.[44] O leite humano contén tamén cantidades significativas de colesterol.[45]
Desde un punto de vista dietético, os alimentos vexetais conteñen cantidades pouco significativas de coleserol.[44][46] Ademais, os produtos vexetais como o aguacate,[47] sementes de liño e cacahuetes conteñen compostos similares ao colesterol chamados fitosterois, que se cre compiten co colesterol durante a súa absorción intestinal, polo que reducen a absorción tanto do colesterol da dieta coma do biliar.[48] Os fitosterois poden ser suplementados usando alimentos funcionais ou nutracéuticos que conteñan fitosterois, que son eficaces rebaixando a cantidade de lipoproteínas LDL.[49] As guías de suplementación actual recomendan doses de fitosterois de 1,6 a 3,0 gramos por día (Health Canada, EFSA, ATP III, FDA) e unha metaanálise recente demostrou que se produce unha redución do 8,8% no colesterol LDL consumindo unha dose media de 2,15 gramos por día.[50] Non obstante, os beneficios dunha dieta suplementada con fitosterois foron cuestionados.[51][52]
A fracción do colesterol da dieta que se absorbe varía do 15% ao 75%, e como media é do 50%, e o resto excrétase nas feces.[53] É moito máis probable que se absorba o colesterol libre que o colesterol esterificado, e a proporción do libre con respecto ao esterificado varía segundo o alimento.[54] O consumo de colesterol na dieta non se correlaciona ben cos niveis de coleserol séricos. Atopáronse fortes evidencias de que substituír as graxas saturadas por insaturadas rebaixa os niveis de colesterol LDL, e de que as dietas baixas en graxa que substitúen a graxa por carbohidratos baixan tanto os niveis de colesterol LDL coma os de colesterol HDL.[55] As graxas trans reducen os niveis de HDL pero aumentan os de LDL.[56] Baseándose nestas evidencias e nas que implican os niveis baixos de HDL e altos de LDL nas enfermidades cardiovasculares moitas autoridades sanitarias rcomendan reducir o colesterol LDL cambiando a dieta, ademais de modificando o estilo de vida.[57]
Importancia clínica
[editar | editar a fonte]Hipercolesterolemia
[editar | editar a fonte]
Segundo a hipótese lipídica, como o colesterol (e outras moléculas graxas) se transporta polo corpo (na auga do fluído extracelular) no interior de patículas de lipoproteínas, e as concentracións elevadas de colesterol (hipercolesterolemia) están asociadas coas enfermidades cardiovasculares e a formación de ateromas, polo que a medición dos seus niveis no soro sanguíneo dan unha indicación do risco de sufrir esas doenzas.
Este proceso da doenza aterosclerótica, ao longo de décadas, orixina os infartos de miocardio (ataque ao corazón), accidentes cerebrovasculares e a enfermidade vascular periférica. Como un alto nivel sanguíneo de LDL, especialmente unha maior concentración de partículas LDL e un menor tamaño das partículas LDL, contribúen a este proceso máis do que o fai o contido de colesterol das partículas HDL,[58] as partículas LDL adoitan denominarse "colesterol malo" porque están ligadas á formación de ateromas. Por outra parte, as altas concentracións de HDL funcionais, que poden retirar o colesterol das células e dos ateromas, dan protección e denomínase "colesterol bo". Os balances entre estas partículas están maiormente determinados xeneticamente, pero poden ser cambiados pola práctica do culturismo, medicamentos, tipo de alimentación,[59] e outros factores.[60]
Condicións nas que hai unha elevada concentración de partículas LDL oxidadas, especialmente a de "LDL densas pequenas" (sdLDL, "small dense LDL"), están asociadas coa formación de ateromas nas paredes das arterias, unha condición coñecida como aterosclerose, que é a causa principal de enfermidade coronaria e outras formas de enfermidade cardiovascular. En contraste co anterior, as partículas HDL (especialmente as HDL grandes) foron identificadas como un medio polo cal o colesterol e os mediadores inflamatorios poden ser retirados dos ateromas. Un incremento das concentracións de HDL correlaciónase con menor rapidez na progresión dos ateromas e mesmo coa súa regresión. Un estudo de recompilación de datos de 2007 de case 900.000 individuos de 61 cohortes demostraron que os niveis de colesterol sanguíneo total teñen un efecto expoñencial na mortalidade cardiovascular e mortalidade total, e a asociación é máis pronunciada nos suxeitos máis novos. Porén, como as enfermidades cardiovasculares son relativamente raras na poboación máis nova, o impacto dos niveis altos de colesterol sobre a saúde é aínda maior nas persoas de maior idade.[61]
Os niveis elevados das fraccións lipoproteicas LDL, IDL e VLDL considéranse ateroxénicos (favorecen a aterosclerose).[62] Son os niveis destas fraccións, máis que o nivel de colesterol total, os que se correlacionan coa extensión e progresión da aterosclerose. Inversamente, o colesterol total pode estar dentro de límites normais, pero estar constituído maiormente por partículas LDL pequenas e HDL pequenas, e nesas condicións a rapidez do crecemento dos ateromas é alto. Recentemente, unha análise post hoc dos estudos prospectivos IDEAL e EPIC atoparon unha asociación entre os niveis altos de colesterol HDL (axustados para a apolipoproteína A-I e a apolipoproteína B) e un incremento do risco de enfermidade cardiovascular, o que pon en dúbida o papel cardioprotector xeralmente considerado do "colesterol bo".[63]
Os niveis elevados de colesterol trátanse con dietas estritas caracterizada por ser baixas en graxas saturadas, sen graxas trans, baixas en alimentos con moito colesterol,[64][65] a miúdo complementadas coa administración de diversos axentes hipolipidémicos como as estatinas, fibratos, inhibidores da absorción do colesterol, derivados do ácido nicotínico ou secuestrantes de ácidos biliares.[66] Anteriormente os casos extremos mesmo eran tratados con cirurxía de bypass ileal parcial, pero iso foi xa superado polos tratamentos con medicamentos. Os tratamentos baseados en aféreses aínda se usan en casos de hiperlipidemias moi graves que non responden ao tratamento ou requiren unha rápida baixada dos lipidos sanguíneos.[67]
Moitos ensaios clínicos en humanos nos que se usaron inhibidores da HMG-CoA redutase, chamados estatinas, confirmaron repeticamente que o cambio nos patróns de transporte de lipoproteínas de patróns pouco saudables a patróns saudables fan diminuír significativamente as taxas de episodios cardiovasculares, mesmo en persoas con valores de colesterol actualmente considerados baixos para adultos.[68] Tamén se descubriu que as estatinas reducen a progresión dos ateromas.[69] Como resultado, as persoas cun historial de enfermidade cardiovascular poden obter beneficios coa administración de estatinas independentemente dos seus niveis de colesterol (colesterol total por debaixo de 5,0 mmol/L [193 mg/dL]),[70] e en persoas de sexo masculino sen enfermidades cardiovasculares, é beneficioso baixar os niveis de colesterol anormalmente altos ("prevención primaria").[71] A prevención primaria en mulleres aplicábase inicialmente só por extensión dos resultados dos estudos realzados en homes,[72] xa que nas mulleres ningún dos grandes ensaios clínicos con estatinas realizados antes de 2007 demostrararan unha redución estaisticamente significativa na mortalidade global ou en indicadores cardiovasculares.[73] En 2008, un gran ensaio clínico informou que en adultos aparentemente con boa saúde cun incremento dos niveis do biomarcador inflamatorio de alta sensibilidade proteína C reactiva pero cun nivel inicial de LDL baixo, a administración de 20 mg/día de rosuvastatina durante 1,9 anos tivo como resultado unha redución do 44% na incidencia de episodios cardiovasculares e un 20% de redución na mortalidade por calquera causa; o efecto era estatisticamente significativo para ambos os sexos.[74] Aínda que estes resultados foron tomados con certo escepticismo, estudos posteriores e metaanálises demostraron igualmente reducións estatisticamente significativas (pero pequenas) na mortalidade cardiovasculr e global, sen que se observase unha heteroxeneidade significativa por sexos.[75]
| Nivel mg/dL | Nivel mmol/L | Interpretación |
| < 200 | < 5,2 | Nivel desexable correspondente a un risco baixo de enfermidades cardíacas |
| 200–240 | 5,2–6,2 | Límite do risco alto |
| > 240 | > 6,2 | Risco alto |
O informe de 1987 do National Cholesterol Education Program, Adult Treatment Panels dos Estados Unidos suxería que o nivel de colesterol total debería ser: < 200 mg/dL para o colesterol normal en sangue, 200–239 mg/dL para o próximo ao límite alto, > 240 mg/dL para o colesterol alto.[76] A American Heart Association dá un conxunto de directrices similares para os niveis de colesterol total (en xaxún) en sangue e o risco de enfermidade cardíaca:[77]
Con todo, como os métodos de análise actuais poden determinar por separado os niveis de colesterol LDL ("malo") e HDL ("bo"), esta visión un tanto simple baseada no colesterol total quedou xa desfasada. O nivel desexable de LDL considérase de menos de 100 mg/dL (2,6 mmol/L),[78] aínda que un límite superior novo de 70 mg/dL (1,8 mmol/L) pode ser considerado conveniente en individuos con alto risco baseándose nalgúns dos ensaios clínicos antes mencionados. Unha proproción de colesterol total de HDL (outra medida útil) de moito menos que 5:1 crese que é máis saudable.

O colesterol total defínese como a suma de HDL, LDL, e VLDL. Xeralmente, só se miden o colesterol total, HDL, e triglicéridos. Por razóns de custo, as VLDL xeralmente se estiman como un quinto dos triglicéridos e as LDL estímanse usando a fórmula de Friedewald (ou unha variante): LDL estimado = [colesterol total] − [HDL total] − [VLDL estimada]. A VLDL pode calcularse dividindo os triglicéridos totais por 5. As medidas directas de LDL utilízanse cando os triglicéridos superan os 400 mg/dL. As estimacións de LDL e VLDL teñen un maior erro cando os triglicéridos están por riba de 400 mg/dL.[79]
O papel do colesterol nas enfermidades cardiovasculares é xeneralizadamente recoñecido, pero algúns estudos demostraron tamén unha relación inversa entre os niveis de colesterol e a mortalidade. Un estudo de 2009 de pacientes con síndromes coronarias agudas atopou unha asociación entre a hipercolesterolemia e mellores resultados na mortalidade (o que era paradoxal).[80] No Framingham Heart Study, feito en suxeitos de máis de 50 anos, atopouse en incremento do 11% na mortalidade global e un incremento do 14% na mortalidade por enfermidade cardiovascular con 1 mg/dL por ano de baixada nos niveis de colesterol total. Os investigadores atribuíron este fenómeno a que as persoas con enfermidades cardíacas crónicas ou cancro tenden a ter niveis de colesterol por debaixo do normal.[81] Esta explicación non está apoiada polos datos do Vorarlberg Health Monitoring and Promotion Programme, no cal homes de todas as idades e mulleres por riba de 50 anos con niveis de colesterol moi baixos tiñan maior probabilidade de morrer de cancro, enfermidades hepáticas e mentais. Este resultado indica que o efecto do coleserol baixo ocorre mesmo entre os individuos examinados máis novos, o que contradí as afirmacións previas sobre as cohortes de persoas máis vellas de que este é un indicador ou marcador da debilidade que aparece coa idade.[82]
A gran maioría dos doutores e científicos médicos consideran que hai unha ligazón entre o colesterol e a aterosclerose como se discutiu máis arriba;[83] porén, un pequeno grupo de científicos, unidos na Rede Internacional de Escépticos do Colesterol, cuestionan esta ligazón.[84] Baséanse nunha metaanálise de 2014 feita con datos duns 500.000 pacientes, que concluíu que non hai probas suficientes que apoien a recomendación dun consumo alto de ácidos graxos poliinsaturados e baixo de graxas saturadas totais para mater a saúde cardiovascular.[85] Porén, esta metaanálise foi tamén discutida.[86]
Hipocolesterolemia
[editar | editar a fonte]Os niveis anormalmente baixos de colesterol denomínanse hipocolesterolemia. As investigacións que se realizaron sobre as causas deste estado son bastante limitadas, pero algúns estudos suxiren unha ligazón coa depresión, cancro, e hemorraxia cerebral. En xeral, os niveis baixos de colesterol parecen ser unha consecuencia, máis que unha causa, dalgunha doenza subxacente.[61] Un defecto xenético na síntese de colesterol causa a síndrome de Smith-Lemli-Opitz, que está a miúdo asociada cos niveis baixos de colesterol no plasma sanguíneo. O hipertiroidismo ou calquera outro trastorno endócrino que cause unha regulación á alza do receptor de LDL pode ter como resultado a hipocolesterolemia.[87]
Probas do colesterol
[editar | editar a fonte]Recoméndanse facer probas de niveis de colesterol regularmente.[88] Para os pacientes que están tomando estatinas a American Heart Association recomendaba en 2013 unha proba de 4 a 12 semanas despois da primeira dose e despois cada 3 a 12 meses.[89]
Unha mostra de sangue despois de 12 horas de xaxún extraída por un doutor ou un aparello que monitorice o colesterol serve para determinar o perfil de lipoproteínas. Isto mide o colesterol total, o colestero LDL ("malo"), o colesterol HDl ("bo"), e os triglicéridos. Recoméndase comprobar os niveis de colesterol cada cinco anos se a persoa ten un colesterol total de 5,2 mmol/L ou máis (200+ mg/dL), ou se un home (macho) de máis de 45 anos ou unha muller de máis de 50 ten un nivel de colesterol HDL ("bo") menor de 1 mmol/L (40 mg/dL), ou se hai outros factores de risco de enfermidade cardíaca ou accidente cerebrovascular. Outros factores de risco para enfermidades cardíacas son a diabete, hipertensión (ou o uso de medicamentos anti-hipertensivos), baixo nivel de HDL, historia familiar de enfermidades coronarias e hipercolesterolemia, e ser fumador.[90]
Cristais líquidos colestéricos
[editar | editar a fonte]Algúns derivados do colesterol (entre outros lípidos simples colestéricos) xeran o que se chama unha "fase colestérica" cristalina líquida. A fase colestérica é, de feito, unha fase nemática quiral, e cambia de cor cos cambios de temperatura. Isto fai que os derivados do colesterol sexan útiles para indicar a temperatura en termómetros con pantalla de cristal líquido e en pinturas sensibles á temperatura.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 "Safety (MSDS) data for cholesterol". Arquivado dende o orixinal o 12 de xullo de 2007. Consultado o 2007-10-20.
- ↑ Cholesterol Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- ↑ 3,0 3,1 Hanukoglu I (Dec 1992). "Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis.". J Steroid Biochem Mol Biol 43 (8): 779–804. PMID 22217824. doi:10.1016/0960-0760(92)90307-5.
- ↑ Razin S, Tully JG (May 1970). "Cholesterol Requirement of Mycoplasmas". Journal of Bacteriology 102 (2): 306–310. PMC 247552. PMID 4911537.
- ↑ Chevreul (1816) "Recherches chimiques sur les corps gras, et particulièrement sur leurs combinaisons avec les alcalis. Sixième mémoire. Examen des graisses d'homme, de mouton, de boeuf, de jaguar et d'oie" (Investigacións químicas sobre substancias graxas, e particularmente sobre as súas combinacións cos álcalis. Sesta memoria. Estudo das graxas humanas, de ovella, boi, xaguar e ganso), Annales de Chimie et de Physique, 2 : 339-372. De page 346 : "Je nommerai cholesterine, de χολη, bile, et στερεος, solide, la substance cristallisée des calculs biliares humains, ... " (Nomearei colesterina — de χολη (bile) e στερεος (sólido) — á substancia cristalizada dos cálculos biliares humanos... )
- ↑ Olson RE (February 1998). "Discovery of the lipoproteins, their role in fat transport and their significance as risk factors". J. Nutr. 128 (2 Suppl): 439S–443S. PMID 9478044.
- ↑ Westover EJ, Covey DF, Brockman HL, Brown RE, Pike LJ (December 2003). "Cholesterol depletion results in site-specific increases in epidermal growth factor receptor phosphorylation due to membrane level effects. Studies with cholesterol enantiomers". J. Biol. Chem. 278 (51): 51125–33. PMC 2593805. PMID 14530278. doi:10.1074/jbc.M304332200.
- ↑ Kristiana I, Luu W, Stevenson J, Cartland S, Jessup W, Belani JD, Rychnovsky SD, Brown AJ (setembro de 2012). "Cholesterol through the looking glass: ability of its enantiomer also to elicit homeostatic responses". J. Biol. Chem. 287 (40): 33897–904. PMC 3460484. PMID 22869373. doi:10.1074/jbc.M112.360537.
- ↑ "National Health and Nutrition Examination Survey" (PDF). United States Center for Disease Control. Consultado o 2012-01-28.
- ↑ Lecerf JM, de Lorgeril M (2011). "Dietary cholesterol: from physiology to cardiovascular risk". Br J Nutr 106 (1): 6–14. PMID 21385506. doi:10.1017/S0007114511000237.
- ↑ Dubois C, Armand M, Mekki N, Portugal H, Pauli AM, Bernard PM, Lafont H, Lairon D (1994). "Effects of increasing amounts of dietary cholesterol on postprandial lipemia and lipoproteins in human subjects". Journal of LIPID Research 35 (1994): 1993–2007. PMID 7868978.
- ↑ 12,0 12,1 E. J. Behrman and Venkat Gopalan. Cholesterol and Plants. Concepts in Biochemistry. Editado por William M. Scovell, Bowling Green State University, Bowling Green, OH 43403 [1] Arquivado 06 de setembro de 2015 en Wayback Machine.
- ↑ Behrman, E. J.; Gopalan, Venkat (2005). William M. Scovell, ed. "Cholesterol and Plants" (PDF). Journal of Chemical Education 82 (12): 1791. Bibcode:2005JChEd..82.1791B. doi:10.1021/ed082p1791. Arquivado dende o orixinal (PDF) o 21 de outubro de 2012. Consultado o 16 de xaneiro de 2016.
- ↑ John S, Sorokin AV, Thompson PD (February 2007). "Phytosterols and vascular disease". Curr. Opin. Lipidol. 18 (1): 35–40. PMID 17218830. doi:10.1097/MOL.0b013e328011e9e3.
- ↑ Madigan M; Martinko J; Parker J (2003). Pearson-Prentice Hall, ed. Brock Biología de los Microorganismos (10ª ed.). p. 68. ISBN 0-13-066271-2.
- ↑ Sadava D, Hillis DM, Heller HC, Berenbaum MR (2011). Life: The Science of Biology 9th Edition. San Francisco: Freeman. pp. 105–114. ISBN 1-4292-4646-4.
- ↑ Ohvo-Rekilä H, Ramstedt B, Leppimäki P, Slotte JP (January 2002). "Cholesterol interactions with phospholipids in membranes". Prog. Lipid Res. 41 (1): 66–97. PMID 11694269. doi:10.1016/S0163-7827(01)00020-0.
- ↑ Yeagle PL (October 1991). "Modulation of membrane function by cholesterol". Biochimie 73 (10): 1303–10. PMID 1664240. doi:10.1016/0300-9084(91)90093-G.
- ↑ Haines TH (July 2001). "Do sterols reduce proton and sodium leaks through lipid bilayers?". Prog. Lipid Res. 40 (4): 299–324. PMID 11412894. doi:10.1016/S0163-7827(01)00009-1.
- ↑ Incardona JP, Eaton S (April 2000). "Cholesterol in signal transduction". Curr. Opin. Cell Biol. 12 (2): 193–203. PMID 10712926. doi:10.1016/S0955-0674(99)00076-9.
- ↑ Pawlina W, Ross MW (2006). Histology: a text and atlas: with correlated cell and molecular biology. Philadelphia: Lippincott Wiliams & Wilkins. p. 230. ISBN 0-7817-5056-3.
- ↑ Smith LL (1991). "Another cholesterol hypothesis: cholesterol as antioxidant". Free Radic. Biol. Med. 11 (1): 47–61. PMID 1937129. doi:10.1016/0891-5849(91)90187-8.
- ↑ 23,0 23,1 "Biosynthesis and Regulation of Cholesterol (with Animation)". PharmaXChange.info. Arquivado dende o orixinal o 07 de xaneiro de 2018. Consultado o 16 de xaneiro de 2016.
- ↑ Berg J (2002). Biochemistry. New York: WH Freeman. ISBN 0-7167-3051-0.
- ↑ Rhodes CM Stryer L, Tasker R (1995). Biochemistry (4th ed.). San Francisco: W.H. Freeman. pp. 280, 703. ISBN 0-7167-2009-4.
- ↑ Espenshade PJ, Hughes AL (2007). "Regulation of sterol synthesis in eukaryotes". Annu. Rev. Genet. 41: 401–27. PMID 17666007. doi:10.1146/annurev.genet.41.110306.130315.
- ↑ Brown MS, Goldstein JL (1997). "The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor". Cell 89 (3): 331–40. PMID 9150132. doi:10.1016/S0092-8674(00)80213-5.
- ↑ 28,0 28,1 Tymoczko, John L.; Stryer Berg Tymoczko; Stryer, Lubert; Berg, Jeremy Mark (2002). Biochemistry. San Francisco: W.H. Freeman. pp. 726–727. ISBN 0-7167-4955-6.
- ↑ Weingärtner O, Pinsdorf T, Rogacev KS, Blömer L, Grenner Y, Gräber S, Ulrich C, Girndt M, Böhm M, Fliser D, Laufs U, Lütjohann D, Heine GH (2010). Federici M, ed. "The relationships of markers of cholesterol homeostasis with carotid intima-media thickness". PLoS ONE 5 (10): e13467. Bibcode:2010PLoSO...513467W. PMC 2956704. PMID 20976107. doi:10.1371/journal.pone.0013467.
- ↑ Lewis GF, Rader DJ (June 2005). "New insights into the regulation of HDL metabolism and reverse cholesterol transport". Circ. Res. 96 (12): 1221–32. PMID 15976321. doi:10.1161/01.RES.0000170946.56981.5c.
- ↑ Gordon DJ, Probstfield JL, Garrison RJ, Neaton JD, Castelli WP, Knoke JD, Jacobs DR, Bangdiwala S, Tyroler HA (January 1989). "High-density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies". Circulation 79 (1): 8–15. PMID 2642759. doi:10.1161/01.CIR.79.1.8.
- ↑ Kandutsch AA, Chen HW, Heiniger HJ (August 1978). "Biological activity of some oxygenated sterols". Science 201 (4355): 498–501. Bibcode:1978Sci...201..498K. PMID 663671. doi:10.1126/science.663671.
- ↑ Russell DW (December 2000). "Oxysterol biosynthetic enzymes". Biochim. Biophys. Acta 1529 (1–3): 126–35. PMID 11111082. doi:10.1016/S1388-1981(00)00142-6.
- ↑ Hanukoglu I, Jefcoate CR (1980). "Pregnenolone separation from cholesterol using Sephadex LH-20 mini-columns". Journal of Chromatography A 190 (1): 256–262. doi:10.1016/S0021-9673(00)85545-4.
- ↑ Javitt NB (December 1994). "Bile acid synthesis from cholesterol: regulatory and auxiliary pathways". FASEB J. 8 (15): 1308–11. PMID 8001744.
- ↑ Wolkoff AW, Cohen DE (February 2003). "Bile acid regulation of hepatic physiology: I. Hepatocyte transport of bile acids". Am. J. Physiol. Gastrointest. Liver Physiol. 284 (2): G175–9. PMID 12529265. doi:10.1152/ajpgi.00409.2002.
- ↑ Marschall HU, Einarsson C (June 2007). "Gallstone disease". J. Intern. Med. 261 (6): 529–42. PMID 17547709. doi:10.1111/j.1365-2796.2007.01783.x.
- ↑ Philippe Gérard. Metabolism of Cholesterol and Bile Acids by the Gut Microbiota. Pathogens 2014, 3, 14-24; doi:10.3390/pathogens3010014.
- ↑ Gérard P, Lepercq P, Leclerc M, Gavini F, Raibaud P, Juste C (September 2007). "Bacteroides sp. strain D8, the first cholesterol-reducing bacterium isolated from human feces". Appl. Environ. Microbiol. 73 (18): 5742–9. PMC 2074900. PMID 17616613. doi:10.1128/AEM.02806-06.
- ↑ Wipperman MF, Sampson NS, Thomas ST (2014). "Pathogen roid rage: Cholesterol utilization by Mycobacterium tuberculosis". Crit. Rev. Biochem. Mol. Biol. 49 (4): 269–93. PMID 24611808. doi:10.3109/10409238.2014.895700.
- ↑ Thomas ST, Sampson NS (2013). "Mycobacterium tuberculosis utilizes a unique heterotetrameric structure for dehydrogenation of the cholesterol side chain". Biochemistry 52 (17): 2895–2904. PMC 3726044. PMID 23560677. doi:10.1021/bi4002979.
- ↑ Wipperman MF, Yang M, Thomas ST, Sampson NS (2013). "Shrinking the FadE Proteome of Mycobacterium tuberculosis: Insights into Cholesterol Metabolism through Identification of an α2β2 Heterotetrameric Acyl Coenzyme A Dehydrogenase Family". J. Bacteriol. 195 (19): 4331–4341. PMC 3807453. PMID 23836861. doi:10.1128/JB.00502-13.
- ↑ Christie, William (2003). Lipid analysis: isolation, separation, identification, and structural analysis of lipids. Ayr, Scotland: Oily Press. ISBN 0-9531949-5-7.
- ↑ 44,0 44,1 "USDA National Nutrient Database for Standard Reference, Release 21" (PDF). United States Department of Agriculture. Arquivado dende o orixinal (PDF) o 01 de outubro de 2008. Consultado o 2008-10-24.
- ↑ Jensen RG, Hagerty MM, McMahon KE (1 June 1978). "Lipids of human milk and infant formulas: a review" (PDF). Am J Clin Nutr 31 (6): 990–1016. PMID 352132.
- ↑ Behrman EJ, Gopalan V (December 2005). "Cholesterol and Plants". J. Chem. Educ. 82 (12): 1791. Bibcode:2005JChEd..82.1791B. doi:10.1021/ed082p1791.
- ↑ "Copia arquivada". Arquivado dende o orixinal o 16 de xaneiro de 2016. Consultado o 16 de xaneiro de 2016.
- ↑ Ostlund RE, Racette SB, Stenson WF (2003). "Inhibition of cholesterol absorption by phytosterol-replete wheat germ compared with phytosterol-depleted wheat germ". Am J Clin Nutr 77 (6): 1385–1589. PMID 12791614.
- ↑ European Food Safety Authority, Journal (2010). "Scientific opinion on the substantiation of health claims related to plant sterols and plant stanols and maintenance of normal blood cholesterol concentrations".
- ↑ Demonty I, Ras RT, van der Knaap HC, Duchateau GS, Meijer L, Zock PL, Geleijnse JM, Trautwein EA (February 2009). "Continuous dose-response relationship of the LDL-cholesterol-lowering effect of phytosterol intake". J. Nutr. 139 (2): 271–84. PMID 19091798. doi:10.3945/jn.108.095125.
- ↑ Weingärtner O, Ulrich C, Lütjohann D, Ismail K, Schirmer SH, Vanmierlo T, Böhm M, Laufs U (February 2011). "Differential effects on inhibition of cholesterol absorption by plant stanol and plant sterol esters in apoE-/- mice". Cardiovasc Res 90 (3): 484–92. PMC 3096304. PMID 21257611. doi:10.1093/cvr/cvr020.
- ↑ Weingärtner O, Böhm M, Laufs U (February 2009). "Controversial role of plant sterol esters in the management of hypercholesterolaemia". Eur. Heart J. 30 (4): 404–9. PMC 2642922. PMID 19158117. doi:10.1093/eurheartj/ehn580.
- ↑ Cohn, Jeffrey S. et. al. (February 2010). "Dietary Phospholipids and Intestinal Cholesterol Absorption". Nutrients 2 (2): 116–127. doi:10.3390/nu2020116.
- ↑ Wilson, Martha D. "Review of cholesterol absorption with emphasis on dietary and biliary cholesterol". citeseerx.ist.psu.edu. Consultado o 2015-05-11.
- ↑ "Copia arquivada" (PDF). Arquivado dende o orixinal (PDF) o 18 de abril de 2016. Consultado o 16 de xaneiro de 2016.
- ↑ Ascherio A, Willett WC (October 1997). "Health effects of trans fatty acids". Am. J. Clin. Nutr. 66 (4 Suppl): 1006S–1010S. PMID 9322581.
- ↑ "High cholesterol levels by NHS". National Health Service. Consultado o 2010-09-14.
- ↑ Brunzell JD, Davidson M, Furberg CD, Goldberg RB, Howard BV, Stein JH, Witztum JL (April 2008). "Lipoprotein management in patients with cardiometabolic risk: consensus statement from the American Diabetes Association and the American College of Cardiology Foundation". Diabetes Care 31 (4): 811–22. PMID 18375431. doi:10.2337/dc08-9018.
- ↑ Department of Health (UK), NHS Choices, "More evidence for Mediterranean diet". 8 March 2011. Arquivado 08 de xaneiro de 2016 en Wayback Machine. Access date: Nov 11, 2015
- ↑ Durrington P (August 2003). "Dyslipidaemia". Lancet 362 (9385): 717–31. PMID 12957096. doi:10.1016/S0140-6736(03)14234-1.
- ↑ 61,0 61,1 Lewington S, Whitlock G, Clarke R, Sherliker P, Emberson J, Halsey J, Qizilbash N, Peto R, Collins R (December 2007). "Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths". Lancet 370 (9602): 1829–39. PMID 18061058. doi:10.1016/S0140-6736(07)61778-4.
- ↑ "Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) Final Report" (PDF). National Institutes of Health. National Heart, Lung and Blood Institute. Arquivado dende o orixinal (PDF) o 01 de outubro de 2008. Consultado o 2008-10-27.
- ↑ van der Steeg WA, Holme I, Boekholdt SM, Larsen ML, Lindahl C, Stroes ES, Tikkanen MJ, Wareham NJ, Faergeman O, Olsson AG, Pedersen TR, Khaw KT, Kastelein JJ (February 2008). "High-density lipoprotein cholesterol, high-density lipoprotein particle size, and apolipoprotein A-I: significance for cardiovascular risk: the IDEAL and EPIC-Norfolk studies". J. Am. Coll. Cardiol. 51 (6): 634–42. PMID 18261682. doi:10.1016/j.jacc.2007.09.060.
- ↑ "How Can I Lower High Cholesterol" (PDF). American Heart Association. Arquivado dende o orixinal (PDF) o 21 de decembro de 2015. Consultado o 2011-04-03.
- ↑ "Diseases and Conditions. High cholesterol: Olive oil, Foods with added plant sterols or stanols, Other changes to your diet". Mayo Clinic. 2012. Consultado o 11 November 2015.
- ↑ National Institute for Health and Clinical Excellence. Clinical guideline 67: Lipid modification. London, 2008. [2]
- ↑ Matthew Lui, Ross Garberich, Craig Strauss, Thomas Davin, and Thomas Knickelbine, Usefulness of Lipid Apheresis in the Treatment of Familial Hypercholesterolemia Journal of Lipids, vol. 2014, Article ID 864317, 6 pages, 2014. doi 10.1155/2014/864317
- ↑ Kizer JR, Madias C, Wilner B, Vaughan CJ, Mushlin AI, Trushin P, Gotto AM, Pasternak RC (May 1, 2010). "Relation of different measures of low-density lipoprotein cholesterol to risk of coronary artery disease and death in a meta-regression analysis of large-scale trials of statin therapy.". The American journal of cardiology 105 (9): 1289–96. PMC 2917836. PMID 20403481. doi:10.1016/j.amjcard.2009.12.051.
- ↑ Nicholls SJ (August 2008). "Rosuvastatin and progression of atherosclerosis". Expert Rev Cardiovasc Ther 6 (7): 925–33. PMID 18666843. doi:10.1586/14779072.6.7.925.
- ↑ "MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial". Lancet 360 (9326): 7–22. July 2002. PMID 12114036. doi:10.1016/S0140-6736(02)09327-3.
- ↑ Shepherd J, Cobbe SM, Ford I, Isles CG, Lorimer AR, MacFarlane PW, McKillop JH, Packard CJ (November 1995). "Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group". N. Engl. J. Med. 333 (20): 1301–7. PMID 7566020. doi:10.1056/NEJM199511163332001.
- ↑ Grundy SM (May 2007). "Should women be offered cholesterol lowering drugs to prevent cardiovascular disease? Yes". BMJ 334 (7601): 982–982. PMC 1867899. PMID 17494017. doi:10.1136/bmj.39202.399942.AD.
- ↑ Kendrick M (May 2007). "Should women be offered cholesterol lowering drugs to prevent cardiovascular disease? No". BMJ 334 (7601): 983–983. PMC 1867901. PMID 17494018. doi:10.1136/bmj.39202.397488.AD.
- ↑ JUPITER Study Group (2008). "Rosuvastatin to Prevent Vascular Events in Men and Women with Elevated C-Reactive Protein". N Engl J Med 359: 2195–2207. doi:10.1056/nejmoa0807646.
- ↑ Brugts JJ, Yetgin T, Hoeks SE, Gotto AM, Shepherd J, Westendorp RG, de Craen AJ, Knopp RH, Nakamura H, Ridker P, van Domburg R, Deckers JW (2009). "The benefits of statins in people without established cardiovascular disease but with cardiovascular risk factors: meta-analysis of randomised controlled trials". BMJ 338: b2376. PMC 2714690. PMID 19567909. doi:10.1136/bmj.b2376.
- ↑ "Report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. The Expert Panel". Arch. Intern. Med. 148 (1): 36–69. January 1988. PMID 3422148. doi:10.1001/archinte.148.1.36.
- ↑ "Cholesterol". American Heart Association. 17 November 2008. Consultado o 2009-02-21.
- ↑ "About cholesterol" – American Heart Association
- ↑ Warnick GR, Knopp RH, Fitzpatrick V, Branson L (January 1990). "Estimating low-density lipoprotein cholesterol by the Friedewald equation is adequate for classifying patients on the basis of nationally recommended cutpoints". Clin. Chem. 36 (1): 15–9. PMID 2297909.
- ↑ Wang TY, Newby LK, Chen AY, Mulgund J, Roe MT, Sonel AF, Bhatt DL, DeLong ER, Ohman EM, Gibler WB, Peterson ED (September 2009). "Hypercholesterolemia paradox in relation to mortality in acute coronary syndrome". Clin Cardiol 32 (9): E22–8. PMID 19645040. doi:10.1002/clc.20518.
- ↑ Anderson KM, Castelli WP, Levy D (April 1987). "Cholesterol and mortality. 30 years of follow-up from the Framingham study". JAMA 257 (16): 2176–80. PMID 3560398. doi:10.1001/jama.257.16.2176.
- ↑ Ulmer H, Kelleher C, Diem G, Concin H (2004). "Why Eve is not Adam: prospective follow-up in 149650 women and men of cholesterol and other risk factors related to cardiovascular and all-cause mortality". J Women's Health (Larchmt) 13 (1): 41–53. PMID 15006277. doi:10.1089/154099904322836447.
- ↑ Daniel Steinberg (2007). The Cholesterol Wars: The Cholesterol Skeptics vs the Preponderance of Evidence. Boston: Academic Press. ISBN 0-12-373979-9.
- ↑ Uffe Ravnskov (2000). The Cholesterol Myths : Exposing the Fallacy that Saturated Fat and Cholesterol Cause Heart Disease. New Trends Publishing, Incorporated. ISBN 0-9670897-0-0.
- ↑ Chowdhury R, Warnakula S, Kunutsor S, Crowe F, Ward HA, Johnson L, Franco OH, Butterworth AS, Forouhi NG, Thompson SG, Khaw KT, Mozaffarian D, Danesh J, Di Angelantonio E (2014). "Association of dietary, circulating, and supplement fatty acids with coronary risk: A systematic review and meta-analysis". Annals of internal medicine 160 (6): 398–406. PMID 24723079. doi:10.7326/M13-1788.
- ↑ Dietary fat and heart disease study is seriously misleading. http://www.hsph.harvard.edu/nutritionsource/2014/03/19/dietary-fat-and-heart-disease-study-is-seriously-misleading/
- ↑ Rizos, C.V. (24 February 2011). "Effects of Thyroid Dysfunction on Lipid Profile". The Open Cardiovascular Medicine Journal 5 (1): 76–84. doi:10.2174/1874192401105010076.
- ↑ "How To Get Your Cholesterol Tested". American Heart Association. Consultado o 2013-07-10.
- ↑ Stone NJ, Robinson J, Goff DC, Jr (2013). "Getting a grasp of the Guidelines". American College of Cardiology. Arquivado dende o orixinal o 07 de xullo de 2014. Consultado o 2 April 2014.
- ↑ "Implications of Recent Clinical Trials for the ATP III Guidelines". National Heart, Lungs and Blood Institute. Arquivado dende o orixinal o 02 de febreiro de 2014. Consultado o 2014-01-27.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Hipercolesterolemia familiar
- Lista do contido de colesterol nos alimentos
- Enfermidade de Niemann–Pick Tipo C
- Oxicolesterol
Ligazóns externas
[editar | editar a fonte]- GMD MS Spectrum
- Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults US National Institutes of Health Adult Treatment Panel III
- American Heart Association – "About Cholesterol"
- Colesterol en Lab Tests Online Arquivado 16 de xaneiro de 2016 en Wayback Machine.
- ColestestrolArquivado 04 de xaneiro de 2016 en Wayback Machine.










