Metabolismo dos ácidos graxos
O metabolismo dos ácidos graxos é o conxunto dos procesos metabólicos nos que interveñen ou están estreitamente relacionados cos ácidos graxos, unha familia de moléculas dentro dos macronutrientes lipídicos. Estes procesos poden dividirse en dous grandes ramas: (1) procesos catabólicos que xeran enerxía, e (2) procesos anabólicos que proporcionan os bloques de construción que cómpren para sintetizar outros compostos.[1]
No catabolismo, os ácidos graxos son metabolizados para producir enerxía, principalmente en forma de adenosín trifosfato (ATP). Cando se comparan con outra clase de macronutrientes (carbohidratos e proteínas), os ácidos graxos contidos nos lípidos renden máis enerxía por gramo, cando son completamente oxidados a CO2 e auga por medio da beta-oxidación e o ciclo do ácido cítrico.[2] Os ácidos graxos (principalmente en forma de triglicéridos) son, por tanto, a principal forma de almacenamento de combustible na maioría de animais e, en menor medida, nas plantas.
No anabolismo, os ácidos graxos intactos son importantes precursores de triglicéridos, fosfolípidos, segundos mensaxeiros, hormonas e corpos cetónicos. Por exemplo, os fosfolípidos que forman as bicapas de fosfolípidos que constitúen as membranas (plasmática, nuclear, membranas de orgánulos) da célula orixínanse a partir de ácidos graxos e outros compoñentes. Noutras rutas metabólicas os ácidos graxos son modificados para formar outros compostos como segundos mensaxeiros e hormonas locais. As prostaglandinas fórmanse a partir de ácido araquidónico almacenado na membrana plasmática e probablemente son as hormonas de acción local mellor coñecidas.
Catabolismo dos ácidos graxos
[editar | editar a fonte]



Os ácidos graxos almacénanse como triglicéridos nos depósitos de graxa do tecido adiposo, formados por células chamadas adipocitos, que teñen no seu interior unha gran pinga de graxa. Entre as comidas son liberados deses depósitos do seguinte xeito:
- Lipólise. A separación das cadeas de ácido graxo do glicerol ao que estaban unidas na súa forma de almacenamento de triglicéridos (as graxas), lévana a cabo as lipases. Estas lipases son activadas por niveis altos de adrenalina e glicagón no sangue (ou de noradrenalina segregada polo nervios simpáticos no tecido adiposo), causados polo declive dos niveis de glicosa despois das comidas, o cal simultaneamente diminúe o nivel de insulina no sangue.[1]
- Unha vez liberados do glicerol, os ácidos graxos entran no sangue, que os transporta polo corpo unidos á seroalbumina.[4]
- Os ácidos graxos de cadea longa entran nas células metabolizadoras (é dicir a maior parte das células do corpo menos os eritrocitos e neuronas do sistema nervioso central) por medio de proteínas de transporte específicas, como a familia de proteínas transportadoras de ácidos graxos SLC27 (do inglés solute carriers, transportadoras de solutos).[5][6] Os eritrocitos non conteñen mitocondrias e, por tanto, son incapaces de metabolizar os ácidos graxos; os tecidos do sistema nervioso central non poden usar os ácidos graxos malia conteren mitocondrias, porque os ácidos graxos de cadea longa (a diferenza dos ácidos graxos de cadea media[7][8]) non poden cruzar a barreira hematoencefálica[9] e pasar aos fluídos intersticiais que bañan as súas células.
- Unha vez dentro da célula, a acilo graxo de cadea longa-CoA ligase cataliza a reacción entre unha molécula de ácido graxo e un ATP (que se degrada a AMP e pirofosfato inorgánico) para dar un acilo graxo-adenilato, o cal despois reacciona con coencima A libre para dar unha molécula de acilo graxo-CoA.
- Para que o acil-CoA entre na mitocondria utilízase a lanzadeira da carnitina:[10][11][12]
- O acil-CoA é transferido ao grupo hidroxilo da carnitina por acción da carnitina palmitoiltransferase I, localizada na cara citosólica da membrana mitocondrial externa e da interna.
- A acil-carnitina é enviada ao interior por unha carnitina-acilcarnitina translocase, á vez que a carnitina se envía fóra.
- A acil-carnitina é convertida de novo en acil-CoA pola carnitina palmitoiltransferase II, localizada na cara interior da membrana mitocondrial interna. A carnitina liberada envíase de volta ao citosol conforme un acil-CoA é enviado á matriz mitocondrial.
- A beta-oxidación da matriz mitocondrial corta despois as cadeas carbonadas longas dos ácidos graxos (en forma de moléculas de acil-CoA) nunha serie de unidades de dous carbonos de (acetato), o cal, combinado co coencima A forma moléculas de acetil-CoA, que se condensa con oxalacetato para formar citrato ao "principio" do ciclo do ácido cítrico.[2] É conveniente considerar esta reacción como un "punto de inicio", xa que proporciona o combutible (o acetil-CoA) ao ciclo do ácido cítrico, que será convertido en CO2 e H2O con liberación de enerxía, almacenada como ATP, durante o propio ciclo e na posterior fosforilación oxidativa.
- Brevemente, os pasos na beta-oxidación son os seguintes:[2]
- Deshidroxenación pola acil-CoA deshidroxenase, rendendo 1 molécula de FADH2
- Hidratación pola enoíl-CoA hidratase
- Deshidroxenación pola 3-hidroxiacil-CoA deshidroxenase, rendendo 1 molécula de NADH + H+
- Corte pola tiolase, rendendo 1 molécula de acetil-CoA e un ácido graxo que agora quedou acurtado en 2 carbonos (formando un novo acil-CoA máis pequeno).
- Esta reacción da beta-oxidación é repetida ata que o ácido graxo foi completamente reducido a acetil-CoA ou, no caso dos ácidos gaxos con número impar de carbonos, a acetil-CoA e unha molécula de propionil-CoA por molécula de ácido graxo. Cada corte beta-oxidativo da molécula de acil-CoA finalmente rende 5 moléculas de ATP na fosforilación oxidativa.[13][14]
- O acetil-CoA producido pola beta-oxidación entra no ciclo do ácido cítrico mitocondrial ao combinarse co oxalacetato para formar citrato. Acoplado á fosforilación oxidativa isto ten como resultado a completa degradación do acetil-CoA en CO2 e auga. A enerxía liberada neste proceso é capturada en forma dunha molécula de GTP e 11 de ATP por molécula de acetil-CoA oxidada.[2][10] Ese é o destino do acetil-CoA sempre que ocorre a beta-oxidación de ácidos graxos, excepto baixo certas circunstancias no figado.
- Despois, o propionil-CoA é convertido en succinil-CoA pola propionil-CoA carboxilase (PCC) dependente de biotina e a metilmalonil-CoA mutase (MCM) dependente de vitamina B12, secuencialmente.[15][16] O succinil-CoA convértese primeiro en malato e despois en piruvato, onde é despois transportado á matriz para entrar no ciclo do ácido cítrico.
No fígado o oxalacetato pode ser total ou parcialmente desviado á vía gliconeoxénica durante o xaxún, a inanición, nas dietas baixas en carbohidratos, exercicios extenuantes prolongados e na diabetes mellitus tipo 1 non controlada. Baixo estas circunstancias, o oxalacetato é deshidroxenado a malato, o cal é despois tomado polas mitocondrias das células do fígado para ser convertido en glicosa no citioplasma dos hepatocitos, desde onde se libera ao sangue.[10] Por tanto, no fígado o oxalacetato non está dispoñible para a condensación co acetil-CoA cando se estimulou unha gliconeoxénese significativa polas concentracións sanguíneas baixas (ou ausentes) de insulina e altas de glicagón. Baixo estas condicións, o acetil-CoA é desviado á formación de acetoacetato e beta-hidroxibutirato.[10] O acetoacetato, o beta-hidroxibutirato e o seu produto de degradación espontánea, a acetona, denomínanse corpos cetónicos. As cetonas son liberadas polo fígado ao sangue. Todas as células con mitocondrias poden captar cetonas do sangue e reconvertelas en acetil-CoA, que poden despois utilizarse como combustible no ciclo do ácido cítrico, xa que ningún outro tecido pode desviar o seu oxalacetato á vía gliconeoxénica da maneira en que ocorre no fígado. A diferenza dos ácidos graxos libres, as cetonas poden cruzar a barreira hematoencefálica e están, por tanto, dispoñibles como combustible para as células do sistema nervioso central, actuando como substitutas da glicosa, da cal estas células normalmente sobreviven.[10] A aparición de altos niveis de cetonas no sangue durante a inanición, dietas baixas en carbohidratos, exercicios fortes prolongados ou diabetes mellitus tipo 1 incontrolada coñécese como cetose, a cal, na súa forma extrema, na diabetes mellitus tipo 1 fóra de control denomínase cetoacidose.
- O glicerol liberado por acción da lipase é fosforilado pola glicerol quinase no fígado (o único tecido no que ocorre esta reacción), e o glicerol 3-fosfato resultante é oxidado a dihidroxiacetona fosfato. O encima glicolítico triosa fosfato isomerase converte este composto en gliceraldehido 3-fosfato, o cal é oxidado na glicólise, ou convertido en glicosa na gliconeoxénese.
Os ácidos graxos como fonte de enerxía
[editar | editar a fonte]
55H
98O
6
Os ácidos graxos, almacenados no corpo como triglicéridos, son unha fonte de enerxía concentrda porque conteñen pouco oxíxeno e son anhidros. A enerxía que rende un gramo de ácidos graxos é aproximadamente de 9 kcal (37 kJ), moito maior que as 4 kcal (17 kJ) que rendería 1 g de carbohidratos. Como a porción hidrocarbonada dos ácidos graxos é hidrófoba, estas moléculas poden almacenarse nun ambiente relativamente anhidro (sen auga). Os carbohidratos, por outra parte, están moito máis hidratados. Por exemplo, 1 g de glicóxeno únese a aproximadamente 2 g de auga, o que se traduce a 1,33 kcal/g (4 kcal/3 g). Isto significa que os ácidos graxos poden conter unha cantidade de enerxía por unidade de masa almacenada máis de seis veces maior. Dito doutra maneira, se o corpo humano dependese dos carbohidratos para o almacenamento de enerxía a longo prazo, entón unha persoa tería que conter 31 kg de glicóxeno hidratado para ter unha enerxía equivalente a 4,6 kg (10 lb) de graxas.[10]
Os animais que hibernan son un bo exemplo da utilización das reservas de graxa como combustible metabólico. Por exemplo, os osos hibernan durante uns 7 meses e durante todo ese período a enerxía que consomen deriva da degradación das súas reservas de graxa. As aves migrantes tamén acumulan grandes reservas de graxa antes de emprenderen as súas viaxes, ás veces intercontinentais.[17]
As reservas de graxa dun adulto xove humano como media son de 10 a 20 kg, pero varía grandemente dependendo do xénero e complexión individual.[18] En contraste, o corpo humano almacena só uns 400 g de glicóxeno, dos cales 300 g están localizados dentro dos músculos esqueléticos e non están dispoñibles para todo o corpo no seu conxunto. Os 100 g de glicóxeno almacenados no fígado esgótanse durante un só día sen comer nada.[10] De aí que a glicosa que se libera no sangue desde o fígado para uso xeral polos tecidos do corpo debe sintetizarse a partir de certos aminoácidos (chamados glicoxénicos) e duns poucos substratos máis gliconeoxénicos, entre os que non están os ácidos graxos.[1] Non obstante, a lipólise libera glicerol, que pode entrar na vía da gliconeoxénese.
Síntese de carbohidratos a partir de gicerol e ácidos graxos
[editar | editar a fonte]Os ácidos graxos degrádanse a acetil-CoA por medio da súa oxidación dentro das mitocondrias, mentres que os ácidos graxos sintetízanse a partir do acetil-CoA fóra das mitocondrias, no citosol. As dúas vías son distintas non só no lugar onde ocorren senón tamén nas reaccións que comprenden e substratos utilizados. As dúas vías son mutuamente inhibitorias, o que impide que o acetil-CoA producido pola beta-oxidación entre na ruta sintética por medio da reacción da acetil-CoA carboxilase.[1] Tampouco se pode converter en piruvato, xa que a reacción do complexo da piruvato deshidroxenase é irreversible.[10] En lugar diso, o que ocorre é que o acetil-CoA producido por beta-oxidación dos ácidos graxos condénsase co oxalacetato para entrar no ciclo do ácido cítrico. Durante cada volta do ciclo, dous átomos de carbono saen do ciclo en forma de CO2 nas reaccións de descarboxilación catalizadas pola isocitrato deshidroxenase e a alfa-cetoglutarato deshidroxenase. Así, en cada volta do ciclo do ácido cítrico oxídase unha unidade de acetil-CoA mentres que se rexenera a molécula de oxalacetato coa cal o acetil-CoA se combinou orixinalmente para formar ácido cítrico. As reaccións de descarboxilación ocorren antes de que no ciclo se forme malato.[1] Soamente as plantas posúen encimas que converten o acetil-CoA en oxalacetato, de modo que pode formarse malato para finalmente converterse en glicosa.[1]
Porén, o acetil-CoA pode converterse en acetoacetato, que pode descarboxilarse a acetona (sexa espontaneamente ou catalizado pola acetoacetato descarboxilase). Pode despois seguir metabolizándos a isopropanol, que se excreta no alento e urina, ou pola CYP2E1 en hidroxiacetona (acetol). O acetol pode converterse en propilén glicol. Este convértese en piruvato (por acción de dous posibles encimas), ou en propionaldehido, ou en L-lactaldehido e despois en L-lactato (o isómero común do lactato).[19][20][21] Outra ruta converte o acetol en metilglioxal, despois en piruvato, ou en D-lactaldehido (a través do S-D-lactoíl-glutatión ou doutros modos) e despois en D-lactato.[20][22][23] O metabolismo do D-lactato (á glicosa) é lento ou está alterado en humanos, así a maioría do D-lactato excrétase na urina; deste xeito, o D-lactato derivado da acetona pode contribuír significativamente á acidose metabólica asociada coa cetose ou intoxicación con isopropanol.[20] O L-lactato pode completar a conversión neta de ácidos graxos en glicosa. O primeiro experimento para mostrar a conversión de acetona en glicosa levouse a cabo en 1951. Este e experimentos posteriores usaron carbono con marcaxe isotópica.[21] Ata o 11% da glicosa pode obterse a partir da acetona durante a inanición en humanos.[21]
O glicerol que se libera no sangue durante a lipólise de triglicéridos no tecido adiposo só pode ser captado polo fígado. Alí, convértese en glicerol 3-fosfato pola acción da glicerol quinase, que hidroliza unha molécula de ATP por molécula de glicerol fosforilada. O glicerol 3-fosfato é despois oxidado a dihidroxiacetona fosfato, a cal, á súa vez, convértese en gliceraldehido 3-fosfato polo encima triosa fosfato isomerase. Desde aquí, os tres átomos de carbono do glicerol orixinal poden ser oxidados na glicólise ou convertidos en glicosa na gliconeoxénese.[10]
Outras funcións e usos dos ácidos graxos
[editar | editar a fonte]Sinalización intracelular
[editar | editar a fonte]
Os ácidos graxos son unha parte integral dos fosfolípidos que forman a maior parte da membrana plasmática ou membranas do interior da célula. Estes fosfolípidos poden ser cortados formando un diglicérido e inositol trisfosfato (IP3) por hidrólise do fosfolípido, ou fosfatidilinositol 4,5-bisfosfato (PIP2) por acción do encima unido á membrana fosfolipase C (PLC).[24]
Hormonas parácrinas eicosanoides
[editar | editar a fonte]

Un produto do metabolismo de ácidos graxos son as prostaglandinas, compostos que teñen diversos efectos similares aos das hormonas animais, pero de acción máis local. As prostaglandinas atopáronse en case todos os tecidos humanos e doutros animais. Derivan encimaticamente do ácido araquidónico, un ácido graxo poliinsaturado de 20 carbonos. Todas as prostaglandinas teñen, pois, 20 átomos de carbono e presentan un anel de 5 carbonos. Son unha subclase de eicosanoides e forman a clase dos prostanoides de derivados dos ácidos graxos.[25]
As prostaglandinas sintetízanse na membrana da célula polo corte do araquidonato dos fosfolípidos que constitúen a membrana. Isto pode ser catalizado ou ben pola fosfolipase A2 que actúa directamente sobre os fosfolípidos da membrana, ou ben pola lipase que actúa sobre o diglicérido. Despois, o araquidonato é procesado polo compoñente ciclooxixenase da prostaglandina sintase. Estas forman un anel ciclopentano aproximadamente na parte central da cadea de ácido graxo. A reacción tamén engade 4 átomos de oxíxeno derivados de dúas moléculas de O2. A molécula resultante é a prostaglandina G2, que é convertida polo compoñente hidroperoxidase do complexo encimático en prostaglandina H2. Este composto moi inestable transfórmase rapidamente noutras prostaglandinas, prostaciclina e tromboxanos.[25] Estes son despois liberados nos fluídos intersticiais que rodean as células que fabricaron a hormona local eicosanoide.
Se o araquidonato é transformado por unha lipoxixenase en vez da ciclooxixenase en áidos hidroxieicosatetraenoico e leucotrienos, que tamén actúan como hormonas locais.
As prostaglandinas teñen dous derivados: prostaciclinas e tromboxanos. As prostaciclinas son poderosos vasodilatadores de acción local e inhiben a agregación das plaquetas sanguíneas. Polo seu papel na vasodilatación, as prostaciclinas están tamén implicadas na inflamación. Sintetízanse nas paredes dos vasos sanguíneos e interveñen na función fisiolóxica de impedir a formación innecesaria de coágulos, así como na regulación da contracción de tecido muscular liso.[26] Inversamente, os tromboxanos (producidos polas plaquetas) son vasoconstritores e facilitan a agregación das plaquetas. O seu nome procede do seu papel na formación de coágulos (trombose).
Fontes dietarias de ácidos graxos, a súa dixestión, absorción, transporte polo sangue e almacenamento
[editar | editar a fonte]


Unha proporción significativa dos ácidos graxos do corpo obtense da dieta en forma de triglicéridos de orixe animal ou vexetal. Os ácidos graxos das graxas de animais terrestres adoitan ser saturadas e as de peixes e plantas adoitan ser poliinsaturados (pero non sempre; por exemplo o aceite de palma é saturado).
Estes triglicéridos non poden ser absorbidos polo intestino.[27] Son primeiro degradados a mono- e diglicéridos máis ácidos graxos libres (pero non glicerol libre) pola lipase pancreática, que forma un complexo 1:1 cunha proteína chamada colipase (tamén un constituínte do zume pancreático), que é necesaria para a súa actividade. O complexo activado pode funcionar só na interface auga-graxa. Por tanto, é esencial que as graxas sexan primeiro emulsionadas polos sales biliares para facilitar unha activadade óptima dos encimas.[28] Os produtos de dixestión constan dunha mestura de tri-, di- e monoglicéridos e ácidos graxos libres, que xunto con outros contidos de graxas solubles da dieta (por exemplo, as vitaminas liposolubles e o colesterol) e sales biliares forman micelas mixtas, no contido acuoso duodenal (ver esquemas da dereita).[27][29]
O contido destas micelas (pero non os sales biliares) entran nos enterocitos (células do epitelio interno do intestino delgado), onde son resintetizados os triglicéridos, e empaquetados en quilomicróns que se liberan nos vasos quilíferos (os capilares do sistema linfáico da parede intestinal).[30] Estes vasos quilíferos drenan no conduto torácico linfático, que desemboca no sangue venoso na zona onde se unen a vea xugular esquerda e a subclavia esquerda na parte inferior esquerda do pecozo. Isto significa que os produtos liposolubles da dixestión (incluídos uns poucos ácidos graxos de cadea curta) son descargados directamente na circulación xeral, sen pasaren primeiro polo fígado, a diferenza doutros produtos da dixestión. A razón desta peculiaridade descoñécese.[31]

Os quilomicróns circulan polo corpo, dándolle ao plasma sanguíneo unha aparencia máis turbia e amarelada despois dunha comida con abundante graxa.[32] A lipoproteína lipase das superficies endoteliais dos capilares, especialmente no tecido adiposo, pero en menor medida tamén noutros tecidos, dixire directamente os quilomicróns dando lugar a ácidos graxos libres, monoglicéridos e restos de quilomicróns. Os ácidos graxos absórbenos os adipocitos[33], pero os monoglicéridos cos restos de quilomicróns permanecen no plasma sanguíneo, e finalmente son retirados da circulación polo fígado. Os ácidos graxos libres absorbidos polos adipocitos, serven para resintetizar nesas células triglicéridos usando o glicerol derivado da glicosa na vía glicolítica.[33] Estes triglicéridos son almacenados na pinga de graxa dos adipocitos, ata que se necesiten como combustible metabólico polos outros tecidos do corpo.
O fígado absorbe unha proporción da glicosa do sangue que lle chega pola vea porta procedente dos intestinos. Despois de que o fígado reenche os seus depósitos de glicóxeno (que como máximo son 100 g de glicóxeno) gran parte do resto da glicosa convértese en ácidos graxos como se describe máis adiante. Estes ácidos graxos combínanse co glicerol para formar triglicéridos que se empaquetan en lipoproteínas moi similares aos quilomicróns, coñecidas como lipoproteínas de moi baixa densidade (VLDL). Estas VLDL son procesadas exactamente da mesma maneira que os quilomicróns, excepto que os restos de VLDL constitúen as lipoproteínas de densidade intermedia (IDL), que poden captar o colesterol do sangue. Isto converte as IDL en lipoproteínas de baixa densidade (LDL), que captan as células que necesitan colesterol para as súas membranas ou para a síntese de compostos como as hormonas esteroides). O resto das LDLs é eliminado no fígado.[34]
O tecido adiposo e a glándula mamaria lactante tamén captan glicosa do sangue para a súa conversión en triglicéridos. Isto ocorre da mesma maneira no fígado, agás que estes tecidos non liberan os triglicéridos así producidos como VLDL no sangue. As células do tecido adiposo almacenan os triglicéridos nas súas pingas de graxa, e finalmente libéranos de novo como ácidos graxos libres e glicerol ao sangue (como se describe máis arriba en #Catbolismo dos ácidos graxos), cando a concentración plasmática de insulina é baixa e a de glicagón e/ou adrenalina é alta.[35] As glándulas mamarias descargan as graxas (como gotas de graxa) no leite que producen baixo a influencia da hormona prolactina da pituitaria anterior.
Todas as células do corpo necesitan fabricar e manter as súas membranas. Non se sabe se todas as células obteñen a totalidade dos ácidos graxos absorbéndoos do sangue, ou poden sintetizar os seus propios ácidos graxos a partir de glicosa sanguínea. As células do sistema nervioso central case con seguridade poden fabricar os seus propios ácidos graxos, xa que estas moléculas non poderían atravesar a barreira hematoencefálica.[36] Porén, non se sabe como conseguen os ácidos graxos esenciais, que os mamíferos non poden sintetizar nos seus corpos e deben tomalos na dieta, xa que son necesarios para as membranas e para outras funcións sintéticas.
Síntese de áacidos graxos
[editar | editar a fonte]- Artigo principal: Síntese de ácidos graxos.

De xeito parecido ao que ocorre na beta-oxidación, a síntese de ácidos graxos saturados de cadea recta ocorre polas seis reaccións que se mostran abaixo, que se repiten ata que se forme o ácido palmítico de 16 carbonos.[37][38]
O esquema mostra como se sintetizan os ácidos graxos en bacterias e indica os encimas que se encontran en Escherichia coli.[37] Estas reaccións catalízaas a ácido graxo sintase II (FASII), que en xeral contén múltiples encimas que actúan formando un só complexo. A FASII está presente en procariotas, plantas, fungos, e parasitos, e tamén nas mitocondrias.[39]
En animais e fungos como os lévedos ocorren estas mesmas reaccións pero catalizadas pola ácido graxo sintase I (FASI), unha gran proteína dímera que ten todas as actividades encimáticas que cómpren para crear ácidos graxos. A FASI é menos eficiente que a FASII; porén, permite a formación de máis moléculas, incluíndo os ácidos graxos de "cadea media" por medio dunha terminación temperá da cadea.[39] Os encimas aciltransferases e transacilases, incorporan os ácidos graxos aos fosfolípidos, triaglicéridos, etc. ao transferiren os ácidos graxos entre un aceptor e un doante de acilos. Tamén teñen a tarefa de sintetizar lípidos bioactivos así como as súas moléculas precursoras.[40]
Unha vez que se formou o ácido graxo 16:0, sofre varias modificacións, que teñen como resultado a desaturación e/ou elongación. A elongación, que empeza co estearato (18:0), realízase principalmente no retículo endoplasmático por varios encimas unidos a membranas. Os pasos encimáticos implicados no proceso de elongación son principalmente os mesmos que os que se levan a cabo na síntese de ácidos graxos, pero os catro pasos principais sucesivos da elongación realízanos proteínas individuais, que poden estar fisicamente asociadas.[41][42]
| Paso | Encima | Reacción | Descrición |
|---|---|---|---|
| (a) | Acetil CoA:ACP transacilase | Activa o acetil-CoA para a reacción co malonil-ACP | |
| (b) | Malonil CoA:ACP transacilase | Activa o malonil-CoA para a reacción co acetil-ACP | |
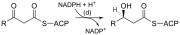
| (c) | 3-Cetoacil-ACP sintase |  |
Fai reaccionar a ACP-unida á cadea de acilo coa malonil-ACP extensora da cadea |
| (d) | 3-Cetoacil-ACP redutase | Reduce o grupo cetona do carbono 3 a un grupo hidroxilo | |
| (e) | 3-Hidroxiacil ACP deshidrase | Elimina auga | |
| (f) | Enoíl-ACP redutase | Reduce o dobre enlace C2-C3. |
Abreviaturas: ACP – proteína portadora de acilos, CoA – coencima A, NADP – nicotín adenín dinucleótido fosfato.
Nótese que durante a síntese de ácidos graxos o axente redutor é o NADPH, mentres que o axente oxidante na beta-oxidación é o NAD+. Esta diferenza exemplifica un principio xeral que é que se consome NADPH durante as reaccións biosintéticas e xérase NADH nas reaccións que renden enerxía.[36] (Así, o NADPH é tamén necesario para a síntese de colesterol a partir de acetil-CoA; mentres que o NADH xérase durante a glicólise.) A fonte de NADPH é dobre. Cando o malato é descarboxilado oxidativamente polo “encima málico ligado a NADP+", fórmanse piruvato, CO2 e NADPH. O NADPH tamén se forma pola ruta da pentosa fosfato que converte a glicosa en ribosa, que se pode usar para a síntese de nucleótidos e áidos nucleicos ou pode catabolizarse a piruvato.[36]
Produtos finais glicolíticos usados na conversión de carbohidratos en ácidos graxos
[editar | editar a fonte]- Artigo principal: Ciclo do ácido cítrico.
Nos humanos os ácidos graxos fórmanse a partir de carbohidrtos predominantemente no fígado e tecido adiposo e na glándula mamaria lactante. O piruvato producido na glicólise é un importnte intermediario na conversión de carbohidrastos en ácidos graxo e colesterol.[36] Isto ocorre pola conversión do piruvato en acetil-CoA nas mitocondrias. Porén, este acetil-CoA debe ser transportado ao citosol, onde ten lugar a síntese de ácidos graxos e colesterol. Isto non pode ocorrer directamente. Para obter acetil-CoA citosólico procedente das mitocondrias, o citrato (producido pola condensación do acetil-CoA co oxalacetato) retírase do ciclo do ácido cítrico mitocondrial e transpórtase a través da membrana mitocondrial interna ata o citosol.[36] Alí é procesado pola ATP citrato liase orixinando acetil-CoA e oxalacetato. O oxalacetto volve ás mitocondrias en forma de malato (que despois se convertirá outra vez en oxalacetato para volver a sacar máis acetil-CoA das mitocondrias).[43] O acetil-CoA citosólico é carboxilado pola acetil CoA carboxilase a malonil-CoA, o primeiro paso destinado á síntese de ácidos graxos.[43][44]
Regulación da síntese de ácidos graxos
[editar | editar a fonte]O acetil-CoA convértese en malonil-CoA pola acción da acetil-CoA carboxilase, e ese malonil-CoA destínase a alimentar a vía da síntese de ácidos graxos. A acetil-CoA carboxilase é o punto de regulación na síntese de ácidos graxos saturados de cadea recta, e está suxeito a fosforilación e regulación alostérica. A regulación da fosforilación ocorre principalmente en mamíferos, mentres que a regulación alostérica ocorre na maioría dos organismos. O control alostérico ten lugar como unha inhibición de retroalimentación polo palmitoíl-CoA e unha activación polo citrato. Cando hai altos niveis de palmitoíl-CoA, que é o produto final da síntese de ácidos graxos saturados, este inactiva alostericamente a acetil-CoA carboxilase para impedir unha acumulación de ácidos graxos na célula. Os altos niveis de citrato actúan activando a acetil-CoA carboxilase, porque estes altos niveis indican que hai acetil-CoA dabondo para alimentar o ciclo do ácido cítrico e producir enerxía.[45]
Os niveis plasmáticos altos de insulina (por exemplo, despois das comidas) causan a desfosforilación e activación da acetil-CoA carboxilase, o que promove a formación de malonil-CoA a partir de acetil-CoA, e consecuentemente a conversión de carbohidratos en ácidos graxos, mentres que a adrenalina e o glicagón (liberados no sangue durante a fame e o exercicio) causan a fosforilación deste encima, inhibindo a lipoxénese en favor da oxidación dos ácidos graxos por beta-oxidación.[36][44]
Trastornos
[editar | editar a fonte]Os trastornos do metabolismo dos ácidos graxos poden ser a hipertrigliceridemia (niveis moi altos de triglicéridos), ou outros tipos de hiperlipidemias. Estas poden ser familiares (herdadas) ou adquiridas.
Os trastornos de tipo familiar do metabolismo de ácidos graxos son trastornos xenéticos herdados do metabolismo lipídico. Estes trastornos poden describirse como trastornos da oxidación dos ácidos graxos ou trastornos do almacenamento de ácidos graxos, que son o resultado de defectos xenéticos en encimas ou proteínas de transporte que afectan á capacidade do corpo de oxidar os ácidos graxos para producir enerxía nos músculos, fígado e outros tecidos. Cando un trastorno da oxidación dos ácidos graxos afecta os músculos é un tipo de miopatía metabólica.
Ademais, as células cancerosas poden presentar un metabolismo dos ácidos graxos irregular con respecto á síntese de ácidos graxos[46] e a oxidación de ácidos graxos mitocondrial[47] que está implicado en diversos aspectos da tumoroxénese e crecemento celular.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Stryer, Lubert (1995). "Fatty acid metabolism.". In: Biochemistry. (Fourth ed.). New York: W.H. Freeman and Company. pp. 603–628. ISBN 0-7167-2009-4.
- ↑ 2,0 2,1 2,2 2,3 "Oxidation of fatty acids". Arquivado dende o orixinal o 08 de xaneiro de 2018. Consultado o 16 de maio de 2023.
- ↑ Zechner R, Strauss JG, Haemmerle G, Lass A, Zimmermann R (2005). "Lipolysis: pathway under construction". Curr. Opin. Lipidol. 16 (3): 333–40. PMID 15891395. doi:10.1097/01.mol.0000169354.20395.1c.
- ↑ "Mobilization and cellular uptake of stored fats (triacylglycerols) (with animation)". Arquivado dende o orixinal o 09 de febreiro de 2023. Consultado o 16 de maio de 2023.
- ↑ Stahl, Andreas (1 de febreiro de 2004). "A current review of fatty acid transport proteins (SLC27)". Pflügers Archiv: European Journal of Physiology 447 (5): 722–727. PMID 12856180. doi:10.1007/s00424-003-1106-z.
- ↑ Anderson, Courtney M.; Stahl, Andreas (abril de 2013). "SLC27 fatty acid transport proteins". Molecular Aspects of Medicine 34 (2–3): 516–528. PMC 3602789. PMID 23506886. doi:10.1016/j.mam.2012.07.010.
- ↑ Ebert, D.; Haller, RG.; Walton, ME. (xullo de 2003). "Energy contribution of octanoate to intact rat brain metabolism measured by 13C nuclear magnetic resonance spectroscopy". J Neurosci 23 (13): 5928–35. PMC 6741266. PMID 12843297. doi:10.1523/JNEUROSCI.23-13-05928.2003.
- ↑ Marin-Valencia, I.; Good, LB.; Ma, Q.; Malloy, CR.; Pascual, JM. (febreiro de 2013). "Heptanoate as a neural fuel: energetic and neurotransmitter precursors in normal and glucose transporter I-deficient (G1D) brain". J Cereb Blood Flow Metab 33 (2): 175–82. PMC 3564188. PMID 23072752. doi:10.1038/jcbfm.2012.151.
- ↑ Stryer, Lubert (1995). "Fatty acid metabolism.". In: Biochemistry. (Fourth ed.). New York: W.H. Freeman and Company. pp. 770–771. ISBN 0-7167-2009-4.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 10,7 10,8 Stryer, Lubert (1995). Biochemistry. (Fourth ed.). New York: W.H. Freeman and Company. pp. 510–515, 581–613, 775–778. ISBN 0-7167-2009-4.
- ↑ "Activation and transportation of fatty acids to the mitochondria via the carnitine shuttle (with animation)". Arquivado dende o orixinal o 24 de xaneiro de 2018. Consultado o 16 de maio de 2023.
- ↑ Vivo, Darryl C.; Bohan, Timothy P.; Coulter, David L.; Dreifuss, Fritz E.; Greenwood, Robert S.; Nordli, Douglas R.; Shields, W. Donald; Stafstrom, Carl E.; Tein, Ingrid (1998). "l-Carnitine Supplementation in Childhood Epilepsy: Current Perspectives". Epilepsia 39 (11): 1216–1225. ISSN 0013-9580. PMID 9821988. doi:10.1111/j.1528-1157.1998.tb01315.x.
- ↑ [http://pharmaxchange.info/press/2013/10/oxidation-of-odd-carbon-chain-length-fatty-acids/ Oxidation of odd carbon chain length fatty acids]
- ↑ Oxidation of unsaturated fatty acids
- ↑ Wongkittichote P, Ah Mew N, Chapman KA (decembro de 2017). "Propionyl-CoA carboxylase - A review". Molecular Genetics and Metabolism 122 (4): 145–152. PMC 5725275. PMID 29033250. doi:10.1016/j.ymgme.2017.10.002.
- ↑ Halarnkar PP, Blomquist GJ (1989). "Comparative aspects of propionate metabolism". Comp. Biochem. Physiol. B 92 (2): 227–31. PMID 2647392. doi:10.1016/0305-0491(89)90270-8.
- ↑ Stryer, Lubert (1995). Biochemistry. (Fourth ed.). Nova York: W.H. Freeman and Company. p. 777. ISBN 0-7167-2009-4.
- ↑ Sloan, A.W; Koeslag, J.H.; Bredell, G.A.G. (1973). "Body composition work capacity and work efficiency of active and inactive young men". European Journal of Applied Physiology 32: 17–24. doi:10.1007/bf00422426.
- ↑ Ruddick JA (1972). "Toxicology, metabolism, and biochemistry of 1,2-propanediol". Toxicol Appl Pharmacol 21 (1): 102–111. PMID 4553872. doi:10.1016/0041-008X(72)90032-4.
- ↑ 20,0 20,1 20,2 Glew, Robert H. Invited review. "You Can Get There From Here: Acetone, Anionic Ketones and Even-Carbon Fatty Acids can Provide Substrates for Gluconeogenesis". NIgerian Journal of Physiological Science 25 (1): 2–4. Arquivado dende o orixinal o 26 de setembro de 2013. Consultado o 7 de agosto de 2016.
- ↑ 21,0 21,1 21,2 Park, Sung M.; Klapa, Maria I.; Sinskey, Anthony J.; Stephanopoulos, Gregory (1999). "Metabolite and isotopomer balancing in the analysis of metabolic cycles: II. Applications" (PDF). Biotechnology and Bioengineering 62 (4): 398. ISSN 0006-3592. PMID 9921151. doi:10.1002/(sici)1097-0290(19990220)62:4<392::aid-bit2>3.0.co;2-s.
- ↑ Miller DN, Bazzano G; Bazzano (1965). "Propanediol metabolism and its relation to lactic acid metabolism". Ann NY Acad Sci 119 (3): 957–973. Bibcode:1965NYASA.119..957M. PMID 4285478. doi:10.1111/j.1749-6632.1965.tb47455.x.
- ↑ D. L. Vander Jagt; B. Robinson; K. K. Taylor; L. A. Hunsaker (1992). "Reduction of trioses by NADPH-dependent aldo-keto reductases. Aldose reductase, methylglyoxal, and diabetic complications". The Journal of Biological Chemistry 267 (7): 4364–4369. PMID 1537826. doi:10.1016/S0021-9258(18)42844-X.
- ↑ Stryer, Lubert (1995). "Signal transduction cascades.". In: Biochemistry. (Fourth ed.). New York: W.H. Freeman and Company. pp. 343–350. ISBN 0-7167-2009-4.
- ↑ 25,0 25,1 Stryer, Lubert (1995). "Eicosanoid hormones are derived from fatty acids.". In: Biochemistry. (Fourth ed.). New York: W.H. Freeman and Company. pp. 624–627. ISBN 0-7167-2009-4.
- ↑ Nelson, Randy F. (2005). An introduction to behavioral endocrinology (3rd ed.). Sunderland, Mass: Sinauer Associates. pp. 100. ISBN 978-0-87893-617-5.
- ↑ 27,0 27,1 Digestion of fats (triacylglycerols)
- ↑ Hofmann AF (1963). "The function of bile salts in fat absorption. The solvent properties of dilute micellar solutions of conjugated bile salts". Biochem. J. 89 (1): 57–68. PMC 1202272. PMID 14097367. doi:10.1042/bj0890057.
- ↑ Stryer, Lubert (1995). "Membrane structures and dynamics.". In: Biochemistry. (4ª ed.). Nova York: W.H. Freeman and Company. pp. 268–270. ISBN 0-7167-2009-4.
- ↑ Smith, Sareen S. Gropper, Jack L.; Smith, Jack S (2013). Advanced nutrition and human metabolism (6ª ed.). Belmont, CA: Wadsworth/Cengage Learning. ISBN 978-1133104056.
- ↑ Williams, Peter L.; Warwick, Roger; Dyson, Mary; Bannister, Lawrence H. (1989). "Angiology.". In: Gray's Anatomy (Thirty-seventh ed.). Edinburgh: Churchill Livingstone. pp. 841–843. ISBN 0443-041776.
- ↑ A. C. Guyton. Tratado de Fisiologñia Médica. 6ª edición, Interamericana, páxina 1006. ISBN 84-7605-029-1.
- ↑ 33,0 33,1 Marcelin G, Chua S Jr. Contributions of adipocyte lipid metabolism to body fat content and implications for the treatment of obesity. Curr Opin Pharmacol. 2010 Oct;10(5):588-93. doi: 10.1016/j.coph.2010.05.008. Epub 2010 Jun 8. PMID 20860920 ; PMCID: PMC2945394.
- ↑ Stryer, Lubert (1995). "Biosynthesis of membrane lipids and steroids.". In: Biochemistry. (Fourth ed.). Nova York: W.H. Freeman and Company. pp. 697–700. ISBN 0-7167-2009-4.
- ↑ Stralfors, Peter; Honnor, Rupert C. (1989). "Insulin-induced dephosphorylation of hormone-sensitive lipase". European Journal of Biochemistry 182 (2): 379–385. PMID 2661229. doi:10.1111/j.1432-1033.1989.tb14842.x.
- ↑ 36,0 36,1 36,2 36,3 36,4 36,5 Stryer, Lubert (1995). Biochemistry. (Fourth ed.). New York: W.H. Freeman and Company. pp. 559–565, 614–623. ISBN 0-7167-2009-4.
- ↑ 37,0 37,1 Dijkstra, Albert J., R. J. Hamilton, and Wolf Hamm. "Fatty Acid Biosynthesis." Trans Fatty Acids. Oxford: Blackwell Pub., 2008. 12. Print.
- ↑ "MetaCyc pathway: superpathway of fatty acids biosynthesis". MetaCyc Metabolic Pathway Database. BioCyc. (E. coli).
- ↑ 39,0 39,1 Christie, William W. (20 de abril de 2011). "Fatty Acids: Straight-chain Saturated, Structure, Occurrence and Biosynthesis". En American Oil Chemists' Society. AOCS Lipid Library. Arquivado dende o orixinal o 2011-07-21. Consultado o 2011-05-02.
- ↑ Yamashita, Atsushi; Hayashi, Yasuhiro; Nemoto-Sasaki, Yoko; Ito, Makoto; Oka, Saori; Tanikawa, Takashi; Waku, Keizo; Sugiura, Takayuki (2014-01-01). "Acyltransferases and transacylases that determine the fatty acid composition of glycerolipids and the metabolism of bioactive lipid mediators in mammalian cells and model organisms". Progress in Lipid Research (en inglés) 53: 18–81. ISSN 0163-7827. PMID 24125941. doi:10.1016/j.plipres.2013.10.001.
- ↑ "MetaCyc pathway: stearate biosynthesis I (animals)". MetaCyc Metabolic Pathway Database. BioCyc.
- ↑ "MetaCyc pathway: very long chain fatty acid biosynthesis II". MetaCyc Metabolic Pathway Database. BioCyc.
- ↑ 43,0 43,1 Ferre, P.; F. Foufelle (2007). "SREBP-1c Transcription Factor and Lipid Homeostasis: Clinical Perspective". Hormone Research 68 (2): 72–82. PMID 17344645. doi:10.1159/000100426. Consultado o 2010-08-30.
este proceso está resumido graficamente n páxina 73
- ↑ 44,0 44,1 Voet, Donald; Judith G. Voet; Charlotte W. Pratt (2006). Fundamentals of Biochemistry, 2nd Edition. John Wiley and Sons, Inc. pp. 547, 556. ISBN 978-0-471-21495-3.
- ↑ Diwan, Joyce J. "Fatty Acid Synthesis." Rensselaer Polytechnic Institute (RPI) :: Architecture, Business, Engineering, IT, Humanities, Science. Web. 30 Apr. 2011. <"Fatty Acid Synthesis". Arquivado dende o orixinal o 2011-06-07. Consultado o 2011-05-02.>.
- ↑ Ezzeddini R, Taghikhani M, Somi MH, Samadi N, Rasaee, MJ (maio de 2019). "Clinical importance of FASN in relation to HIF-1α and SREBP-1c in gastric adenocarcinoma". Life Sciences 224: 169–176. PMID 30914315. doi:10.1016/j.lfs.2019.03.056.
- ↑ Ezzeddini R, Taghikhani M, Salek Farrokhi A, Somi MH, Samadi N, Esfahani A, Rasaee, MJ (maio de 2021). "Downregulation of fatty acid oxidation by involvement of HIF-1α and PPARγ in human gastric adenocarcinoma and its related clinical significance". Journal of Physiology and Biochemistry 77 (2): 249–260. ISSN 1138-7548. PMID 33730333. doi:10.1007/s13105-021-00791-3.