Vía alternativa do complemento
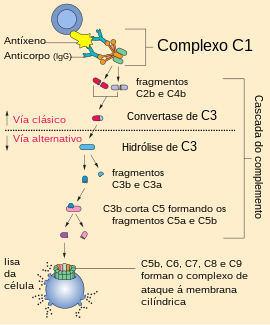

A vía alternativa do complemento é un tipo de cadoiro de reaccións que se dá no sistema do complemento, que é un compoñente do sistema inmunitario innato, unha defensa natural contra infeccións.
A vía alternativa é unha das tres vías do complemento que opsonizan e matan patóxenos. A vía desencadéase cando a proteína C3b se une directamente a microbios. Pode tamén ser iniciada por materiais allleos ao corpo e tecidos danados.
Cadoiro de sinalización
[editar | editar a fonte]Este cambio de forma permite a unión da proteína do plasma factor B, o que permite que o factor D clive o factor B dando Ba e Bb.
Bb permanece unido a C3(H2O) para formar C3(H2O)Bb. Este complexo tamén se coñece como convertase de C3 en fase fluída. Esta convertase, que é a convertase de C3 da vía alternativa, aínda que só se produce en pequenas cantidades, pode clivar múltiples proteínas C3 en C3a e C3b. O complexo crese que é inestable ata que se une á properdina, unha proteína sérica. A adición de properdina forma o complexo C3bBbP, un composto estable que se pode unir a unha molécula adicional de C3b para formar a convertase de C5 da vía alternativa.
A convertase de C5 da vía alernativa consta de (C3b)2BbP (ás veces denominada C3b2Bb). Despois da creación da convertase de C5 (que é (C3b)2BbP ou C4b2a3b da vía clásica), o sistema do complemento segue a mesma ruta sen importar cales fosen os modos de activación (vías alternativa, clásica ou da lectina). A convertase de C5 cliva C5 en C5a e C5b. C5b únese secuencialmente a C6, C7, C8 e despois a moitas moléculas de C9 para formar o complexo de ataque á membrana (MAC).
Regulación
[editar | editar a fonte]Dado que C3b está libre no plasma e é abundante, pode unirse a unha célula hóspede ou a unha superficie dun patóxeno. Para impedir que a activación do complemento actúe sobre a célula hóspede, hai varios tipos de proteínas regulatorias que alteran o proceso de activación do complemento:
- Receptor do complemento 1 (CR1 ou CD35) e DAF (factor acelerador da descomposición tamén coñecido como CD55) compiten co factor B á hora de unirse con C3b na superficie da célula e pode incluso retirar a molécula Bb do complexo C3bBb xa formado.
- A formación da convertase de C3 poden tamén impedirse cando unha protease do plasma chamada factor I do complemento cliva C3b na súa forma inactiva, iC3b. O factor I require unha proteína cofactor que se una a C3b como o factor H do complemento, CR1, ou o cofactor de membrana de proteólise (MCP ou CD46)
- O factor H do complemento pode inhibir a formación da convertase de C3 ao competir co factor B para unirse a C3b;[1] acelera a descomposición da convertase de C3;[2] e actúa como cofactor para a clivaxe de C3b mediada polo factor I.[3] O factor H do complemento únese preferentemente a células de vertebrados (debido á afinidade por residuos de ácido siálico), posibilitando a protección preferente de células do hóspede (en lugar de a células bacterianas) dos danos produidos polo complemento.
- A CFHR5 (proteína relacionada co factor H do complemento 5) pode unirse para actuar como cofactor para o factor I, ten unha actividade aceleradora da decomposición e pode unirse preferentemente a C3b en superficies do hóspede.[4]
Papel en enfermidades
[editar | editar a fonte]A desregulación do sistema do complemento foi implicada en varias doenzas e patoloxía, incluíndo a síndrome hemolítica urémica atípica, na cal a función renal está alterada. A dexeneración macular relacionada coa idade crese agora que está causada, polo menos en parte, pola sobreactivación do complemento nos tecidos retinais.[5] A activación da vía alternativa tamén é significativa en trastornos renais mediados polo complemento, como a xa mencionada síndrome hemolítica urémica atípica, a glomerulopatía de C3 e a glomerulonefrite de C3 (enfermidade de depósito denso ou MPGN tipo II).[5]
Notas
[editar | editar a fonte]- ↑ Conrad DH, Carlo JR, Ruddy S (xuño de 1978). "Interaction of beta1H globulin with cell-bound C3b: quantitative analysis of binding and influence of alternative pathway components on binding". The Journal of Experimental Medicine 147 (6): 1792–1805. PMC 2184316. PMID 567241. doi:10.1084/jem.147.6.1792.
- ↑ Weiler JM, Daha MR, Austen KF, Fearon DT (setembro de 1976). "Control of the amplification convertase of complement by the plasma protein beta1H". Proceedings of the National Academy of Sciences of the United States of America 73 (9): 3268–72. Bibcode:1976PNAS...73.3268W. PMC 431003. PMID 1067618. doi:10.1073/pnas.73.9.3268.
- ↑ Pangburn MK, Schreiber RD, Müller-Eberhard HJ (xullo de 1977). "Human complement C3b inactivator: isolation, characterization, and demonstration of an absolute requirement for the serum protein beta1H for cleavage of C3b and C4b in solution". The Journal of Experimental Medicine 146 (1): 257–70. PMC 2180748. PMID 301546. doi:10.1084/jem.146.1.257.
- ↑ McRae JL, Duthy TG, Griggs KM, Ormsby RJ, Cowan PJ, Cromer BA, McKinstry WJ, Parker MW, Murphy BF, Gordon DL (maio de 2005). "Human factor H-related protein 5 has cofactor activity, inhibits C3 convertase activity, binds heparin and C-reactive protein, and associates with lipoprotein". Journal of Immunology 174 (10): 6250–6. PMID 15879123. doi:10.4049/jimmunol.174.10.6250.
- ↑ 5,0 5,1 Tzoumas, Nikolaos; Hallam, Dean; Harris, Claire L.; Lako, Majlinda; Kavanagh, David; Steel, David H.W. (novembro de 2020). "Revisiting the role of factor H in age-related macular degeneration: Insights from complement-mediated renal disease and rare genetic variants". Survey of Ophthalmology 66 (2): 378–401. ISSN 0039-6257. PMID 33157112. doi:10.1016/j.survophthal.2020.10.008.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Janeway, Charles A. (2005). "The complement system and innate immunity". Immunobiology : the immune system in health and disease (5ª ed.). Nova York: Garland Science. ISBN 978-0-8153-4101-7.
